Bod Varu
Jako kapalina se zahřívá, průměrná kinetická energie jeho částic se zvyšuje. Rychlost odpařování se zvyšuje, protože stále více molekul je schopno uniknout povrchu kapaliny do fáze páry. Nakonec je dosaženo bodu, kdy molekuly v celé kapalině mají dostatek kinetické energie k odpařování. V tomto okamžiku se kapalina začne vařit. Bod varu je teplota, při které se tlak páry kapaliny rovná vnějšímu tlaku. Níže uvedený obrázek znázorňuje varu kapaliny.
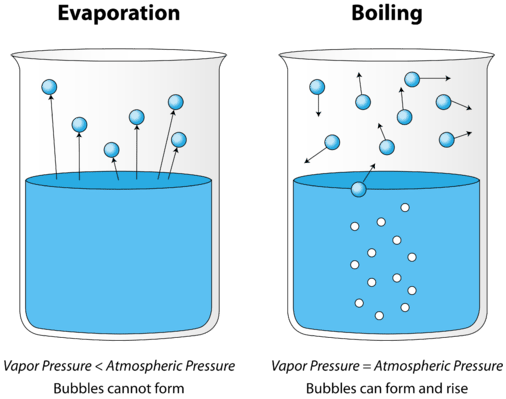
na obrázku vlevo je kapalina pod bodem varu, přesto se část kapaliny odpařuje. Vpravo se teplota zvýšila, dokud se v těle kapaliny nezačnou vytvářet bubliny. Když se tlak par uvnitř bubliny rovná vnějšímu atmosférickému tlaku, bubliny stoupají na povrch kapaliny a prasknou. Teplota, při které dochází k tomuto procesu, je bod varu kapaliny.
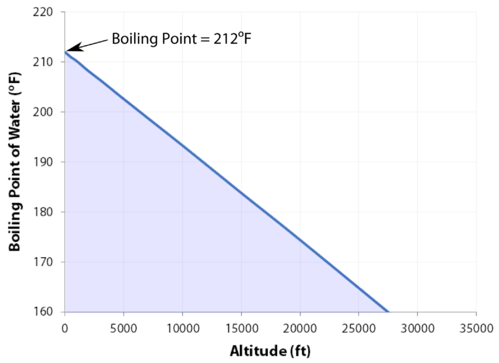
normální bod varu je teplota, při které se tlak páry kapaliny rovná standardnímu tlaku. Protože atmosférický tlak se může měnit v závislosti na umístění, bod varu kapaliny se mění s vnějším tlakem. Normální bod varu je konstantní, protože je definována relativní standardní atmosférický tlak \(760 \: \text{mm} \: \ce{Hg}\) (nebo \(1 \: \text{atm}\) nebo \(101.3 \: \text{kPa}\)).