Redoxní reakce jsou o elektrony předávány z jedné látky na druhou, takže to je užitečné mít systém pro sledování toho, co získá a co ztratí elektrony, a kolik elektronů jsou zapojeny. Systém vedení záznamů pro redoxní reakce se nazývá oxidační čísla. Můžete si také pamatovat něco, co se nazývá elektronegativita z dřívějších tříd chemie.
elektronegativita
schopnost vázaného atomu přitahovat sdílené elektrony k sobě.
Když se dva atomy různých prvků jsou vzájemně spojeny kovalentní vazbu (sdílení elektronů), elektrony nejsou obecně sdíleny rovnoměrně mezi oběma atomy, vzhledem k rozdílům v jejich electronegativities. Ber to jako přetahování elektronů. Někdy se oba atomy táhnout stejnou silou na sdílené elektrony; jindy je jasně silnější hráč, který bude táhnout elektrony blíž k sobě.
zvažte vazbu mezi atomem vodíku (s jedním valenčním elektronem)a atomem kyslíku (se šesti valenčními elektrony):
|
|
+
|
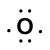 |
=
|
 |
Because oxygen has a higher electronegativity than hydrogen, the shared electrons are closer to the oxygen atom than to atom vodíku. Nejedná se o úplný přenos elektronů, který by vytvořil iont, ale tvoří se částečné náboje. Vodíkový konec vazby je částečně kladný (+1), protože částečně ztratil jeden elektron a kyslíkový konec H-O je částečně záporný (-1), protože částečně získal jeden elektron z vodíku:
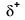 |
|
 |
|
Our molecule is incomplete, however, because there is a lone electron around oxygen. Let’s add one more hydrogen to complete our water molecule:
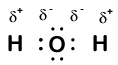
vidíme, že každý ze dvou vodíků „ztratil“ jeden elektron kyslíku. Kyslík „získal“ dva elektrony-jeden z každého vodíku. Opět to nejsou pravé ionty, ale je užitečné myslet na ně stejným způsobem.
náboje dané atomům v molekule tímto způsobem se nazývají oxidační čísla. Pomocí oxidačních čísel můžeme sledovat, kde jsou elektrony v molekule a jak se pohybují během reakce. V našem příkladu vody je vodíku přiděleno oxidační číslo +1, protože každý jednotlivý vodík „ztratil“ jeden elektron. Kyslík má oxidační číslo +2, protože jediný atom kyslíku „získal“ celkem dva elektrony, jeden z každého vodíku.
Zde je další molekuly zahrnující vodík a kyslík—peroxid vodíku, H2O2:
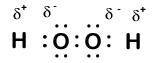
V peroxidu vodíku, každý kyslík má stále oxidační číslo +1, protože každý vodík „vzdá“ elektronu na kyslík. Kyslík má však nyní oxidační číslo -1, protože každý kyslík získává pouze jeden elektron ze sousedního vodíku. Elektrony mezi dvěma identickými atomy kyslíku jsou sdíleny rovnoměrně, takže z této vazby není žádný částečný náboj.
oxidační číslo
kladné nebo záporné číslo přiřazené atomu v molekule nebo iontu, které odráží částečný zisk nebo ztrátu elektronů.
Znalost oxidačního čísla každého jednotlivého prvku v molekule bude klíčovým krokem v našem chápání redoxních reakcí. Naštěstí to obvykle nebude zahrnovat kreslení elektronových bodových diagramů. Místo toho existuje řada pravidel, která můžeme použít k určení oxidačních čísel. Zde jsou hlavní pravidla:
| oxidační číslo čistého prvku (sám o sobě, a ne iont) je nulová. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
The oxidation number of a monatomic ion (by itself or as part of an ionic compound) is equal k jeho náboji. Alkalické kovy—prvky v prvním sloupci periodické tabulky—bude mít vždy oxidační číslo +1; Alkalických zemin, kovy (sloupec 2) jsou téměř vždy +2. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The oxidation number of hydrogen is almost always +1 when it is in a compound. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
oxidační číslo kyslíku je téměř vždy -2, když je ve sloučenině. výjimky:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
součet oxidačních čísel ve sloučenině je nulová. abychom určili oxidační číslo Mn v Mn2O7, musíme pracovat zpět:
-2 × 7 atomů = -14 celkem Protože součet oxidačních čísel musí být nula, celkový oxidační číslo Mn musí být +14 zrušit kyslíku je -14, ale protože tam jsou 2 Mn atomů, každý atom bude mít oxidační číslo +7:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
součet oxidačních čísel v polyatomickém iontu se rovná náboji na tomto iontu. znovu pracujte zpět a určete oxidační číslo jakéhokoli atomu bez kyslíku nebo vodíku. určit oxidační číslo Cr v Cr2O72- :
-2 × 7 = -14
+12 + (-14) = -2
= +7
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
It is je důležité si uvědomit, že oxidační číslo se vždy vztahuje na každý jednotlivý atom ve sloučenině, nikoli na součet tohoto prvku.
například, v H2O, celkový pozitivní „náboj“ pro oba atomy vodíku bude +2 (což vyrovnává s -2 z kyslíku), ale každý vodík má oxidační číslo +1.
Příspěvky & Práce
Tato stránka byla vyrobena z obsahu prostřednictvím následujících přispěvatele(s) a upravovat (lokálně nebo rozsáhle) LibreTexts vývojový tým ke splnění platforma styl, prezentaci, a kvalita:
-
nadace CK-12 Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson a Jean Dupon.