Vzdělávací Cíle
- Používat mobilní notace pro popis galvanických článků
- Popsat základní komponenty galvanické články\
Galvanické články, také známý jako fotovoltaických buněk, jsou elektrochemické články, v nichž spontánní oxidace-redukční reakce výrobě elektrické energie. V psaní rovnic, je často vhodné oddělit oxidačně-redukční reakce do půl reakce pro usnadnění vyrovnávání celkové rovnice a zdůraznit skutečné chemické transformace.
zvažte, co se stane, když se čistý kus měděného kovu umístí do roztoku dusičnanu stříbrného (obrázek \(\PageIndex{1}\)). Jakmile se přidá měděný kov, začne se tvořit stříbrný kov a ionty mědi přecházejí do roztoku. Modrá barva roztoku zcela vpravo indikuje přítomnost iontů mědi. Reakce může být rozdělena do dvou polovičních reakcí. Poloviční reakce oddělují oxidaci od redukce, takže každá může být zvažována individuálně.
rovnice pro snížení půl-reakce musela být zdvojnásobil tak počet elektronů „získal“ ve snížení půl-reakce rovnal počtu elektronů „ztratil“ v oxidaci půl-reakce.

Galvanické nebo fotovoltaické buňky zahrnovat spontánní elektrochemické reakce, v nichž polovina-reakce jsou od sebe odděleny (viz Obrázek \(\PageIndex{2}\)) tak, že proud může proudit přes externí drát. Kádinka na levé straně obrázku se nazývá poločlánek a obsahuje 1 M roztok dusičnanu mědi (II) s kusem měděného kovu částečně ponořeným do roztoku. Měděný kov je elektroda. Měď prochází oxidací; proto je měděná elektroda anodou. Anoda je připojena k voltmetru drátem a druhá svorka voltmetru je připojena ke stříbrné elektrodě drátem. Stříbro prochází redukcí; proto je stříbrná elektroda katodou. Half-mobilní na pravé straně obrázku se skládá ze stříbrné elektrody v 1 M roztoku dusičnanu stříbrného (AgNO3). V tomto okamžiku neproudí žádný proud-to znamená, že nedochází k významnému pohybu elektronů drátem, protože obvod je otevřený. Obvod je uzavřen pomocí solného můstku, který přenáší proud pohyblivými ionty. Solný můstek sestává z koncentrovaného, nereaktivního roztoku elektrolytu, jako je roztok dusičnanu sodného (NaNO3) použitý v tomto příkladu. Jak elektrony proudí zleva doprava elektrodou a drátem, dusičnanové ionty(anionty) procházejí porézní zátkou vlevo do roztoku dusičnanu měďnatého (II). To udržuje kádinku vlevo elektricky neutrální neutralizací náboje na iontech mědi(II), které jsou produkovány v roztoku při oxidaci měděného kovu. Současně se dusičnanové ionty pohybují doleva, sodné ionty (kationty) se pohybují doprava, přes porézní zátku a do roztoku dusičnanu stříbrného vpravo. Tyto přidané kationty „nahrazují“ ionty stříbra, které jsou z roztoku odstraněny, protože byly redukovány na stříbrný kov, udržování kádinky vpravo elektricky neutrální. Bez solného mostu by oddíly nezůstaly elektricky neutrální a neproudil by žádný významný proud. Pokud jsou však obě oddělení v přímém kontaktu, není nutný solný most. V okamžiku, kdy je obvod dokončen, voltmetr čte +0,46 V, nazývá se to buněčný potenciál. Buněčný potenciál je vytvořen, když jsou spojeny dva odlišné kovy, a je měřítkem energie na jednotku náboje dostupné z oxidačně-redukční reakce. Volt je odvozená jednotka si pro elektrický potenciál
\
v této rovnici je a proud v ampérech a C náboj v coulombech. Všimněte si, že volty musí být vynásobeny nábojem v coulombách (C), aby se získala energie v joulech (J).
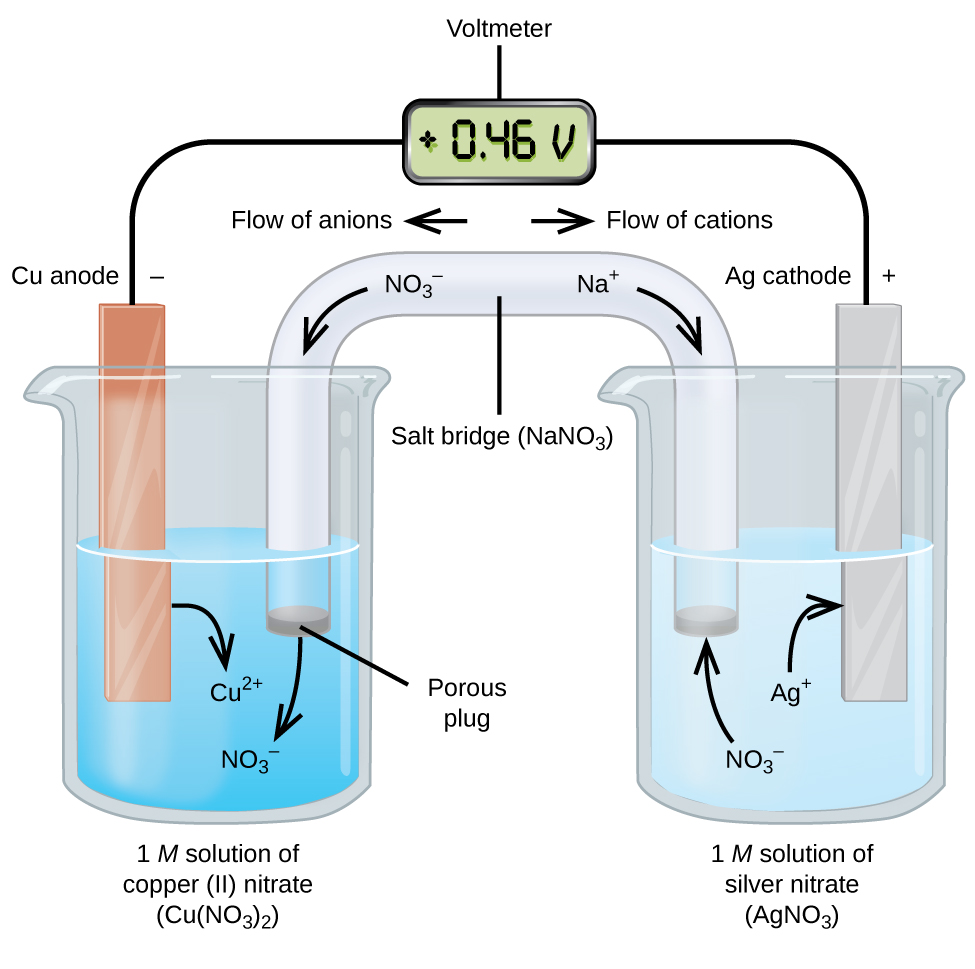
Při elektrochemické buňka je postavena v tomto duchu, pozitivní potenciál buňky označuje spontánní reakce a že elektrony proudí z levé do pravé. Na obrázku \(\PageIndex{2}\) se toho hodně děje, takže je užitečné shrnout věci pro tento systém:
- elektrony proudí z anody do katody: zleva doprava ve standardním galvanickém článku na obrázku.
- elektroda v levém půlčlánku je anoda, protože zde dochází k oxidaci. Název odkazuje na tok aniontů v solném mostě směrem k němu.
- elektroda v pravé půlčlánce je katoda, protože zde dochází k redukci. Název odkazuje na tok kationtů v solném mostě směrem k němu.
- oxidace nastává na anodě (levý poloviční článek na obrázku).
- redukce nastává na katodě (pravá polovina buňky na obrázku).
- buněčný potenciál, + 0,46 V, v tomto případě vyplývá z inherentních rozdílů v povaze materiálů použitých k výrobě dvou poločlánků.
- musí být přítomen solný můstek pro uzavření (dokončení) obvodu a musí dojít k oxidaci i redukci, aby proud proudil.
existuje mnoho možných galvanických článků, takže k jejich popisu se obvykle používá zkratka. Buněčná notace (někdy nazývaná buněčný diagram) poskytuje informace o různých druzích zapojených do reakce. Tato notace funguje také pro jiné typy buněk. Svislá čára,│, označuje fázovou hranici a dvojitou čáru,‖, solný most. Informace o anodě jsou zapsány vlevo, následuje anodový roztok, pak solný můstek (pokud je přítomen), pak roztok katody a nakonec informace o katodě vpravo. Notace buněk pro galvanický článek na obrázku \(\PageIndex{2}\) je pak
\
Všimněte si, že divácké ionty nejsou zahrnuty a že byla použita nejjednodušší forma každé poloviční reakce. Pokud je známo, počáteční koncentrace různých iontů jsou obvykle zahrnuty.
jednou z nejjednodušších buněk je Daniellova buňka. Tuto baterii je možné zkonstruovat umístěním měděné elektrody na dno nádoby a zakrytím kovu roztokem síranu měďnatého. Roztok síranu zinečnatého se vznáší nad roztokem síranu měďnatého; poté se do roztoku síranu zinečnatého umístí zinková elektroda. Připojení měděné elektrody k zinkové elektrodě umožňuje tok elektrického proudu. Toto je příklad buňky bez solného můstku a ionty mohou proudit přes rozhraní mezi oběma řešeními.
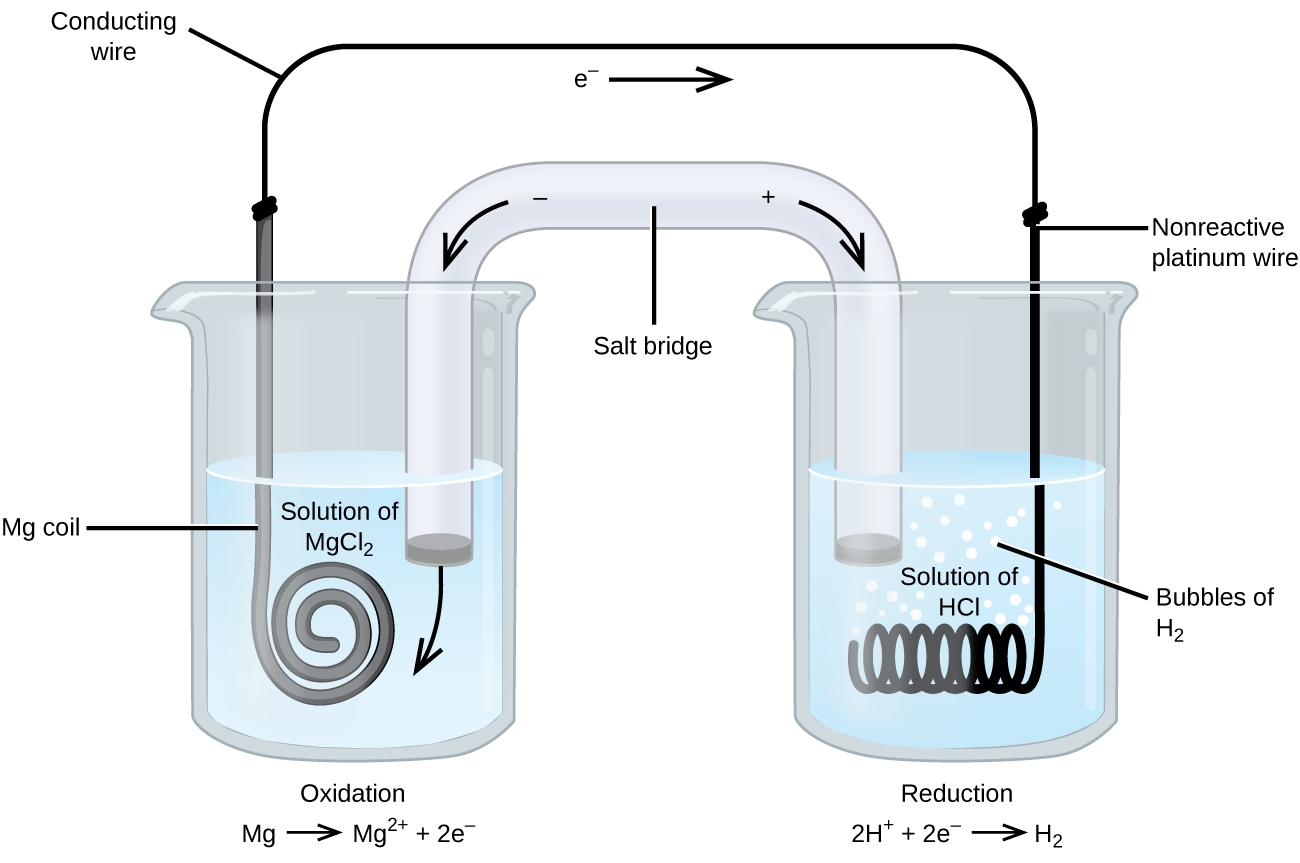
Některé oxidačně-redukční reakce zahrnují druhy, které jsou špatnými vodiči elektřiny, a tak elektroda se používá, že se neúčastní reakce. Elektrodou je často platina, zlato nebo grafit, které jsou inertní vůči mnoha chemickým reakcím. Jeden takový systém je znázorněn na obrázku \(\PageIndex{3}\). Hořčík podléhá oxidaci na anodě vlevo na obrázku a vodíkové ionty podléhají redukci na katodě vpravo. Reakce mohou být shrnuty jako
buňka používá inertní platinové dráty katodou, takže buňka zápis je
hořčík elektroda je aktivní elektroda, protože se podílí na oxidačně-redukční reakci. Inertní elektrody, stejně jako platinová elektroda na obrázku \(\PageIndex{3}\), se neúčastní oxidačně-redukční reakce a jsou přítomny, takže proud může protékat buňkou. Platina nebo zlato obecně vytvářejí dobré inertní elektrody, protože jsou chemicky nereaktivní.
Například \(\PageIndex{1}\): Pomocí Mobilní Notaci,
Zvážit galvanický článek se skládá z
\
Napsat oxidační a redukční poloreakce a psát reakce pomocí mobilní notace. Jaká reakce nastává na anodě? Katoda?
Řešení
Pomocí kontroly, Čr je oxidován, když tři elektrony jsou ztraceny k formě Cr3+, Cu2+ je snížena, jak to získá dva elektrony tvoří Cu. Vyvažování náboje dává
\
notace buněk používá nejjednodušší formu každé z rovnic a začíná reakcí na anodě. Nebyly specifikovány žádné koncentrace, takže:
\
dochází k oxidaci na anodě a ke snížení na katodě.
Například \(\PageIndex{2}\): Pomocí Mobilní Notaci,
Zvážit galvanický článek se skládá z
Napsat oxidační a redukční poloreakce a psát reakce pomocí mobilní notace. Jaká reakce nastává na anodě? Katoda?
Řešení
Pomocí kontroly, Fe2+ podléhá oxidaci, kdy jeden elektron ztratil na formě Fe3+, MnO4−, je snížena, jak to získá pět elektronů formě Mn2+. Vyvažování náboje dává
\
notace buněk používá nejjednodušší formu každé z rovnic a začíná reakcí na anodě. Je nutné použít inertní elektrody, jako je platina, protože tam je kov přítomen na jednání elektrony od anody ke katodě. Nebyly specifikovány žádné koncentrace, takže:
\
dochází k oxidaci na anodě a ke snížení na katodě.
Cvičení \(\PageIndex{1}\)
Použití mobilní notace popsat galvanický článek, kde měď(II) ionty jsou redukovány na kovové mědi a zinku kov se oxiduje na ionty zinku.
Odpovědět
Z informace uvedené v problém:
\
Pomocí mobilní notace:
\
Shrnutí
Elektrochemické buňky, které se obvykle skládají ze dvou půl-buněk. Poloviční články oddělují oxidační poloviční reakci od redukční poloviční reakce a umožňují proud protékat vnějším drátem. Jedna půlčlánek, obvykle znázorněná na levé straně na obrázku, obsahuje anodu. Oxidace probíhá na anodě. Anoda je připojena ke katodě v druhé polovině-buněk, často je znázorněno na pravé straně obrázku. Redukce nastává na katodě. Přidání solného mostu dokončí obvod umožňující tok proudu. Anionty v solném můstku proudí směrem k anodě a kationty v solném můstku proudí směrem ke katodě. Pohyb těchto iontů dokončí obvod a udržuje každý poločlánek elektricky neutrální. Elektrochemické články lze popsat pomocí notace buněk. V tomto zápisu se informace o reakci na anodě objevují vlevo a informace o reakci na katodě vpravo. Solný most je reprezentován dvojitou čárou,‖. Pevné, kapalné nebo vodné fáze v půlčlánku jsou odděleny jednou čarou,│. Fáze a koncentrace různých druhů je zahrnuta za název druhu. Elektrody, které se účastní oxidačně-redukční reakce, se nazývají aktivní elektrody. Elektrody, které se neúčastní oxidačně-redukční reakce, ale jsou tam, aby umožnily proudění proudu, jsou inertní elektrody. Inertní elektrody jsou často vyrobeny z platiny nebo zlata, které jsou nezměněny mnoha chemickými reakcemi.
Slovníček pojmů
aktivní elektrody elektrody, které se účastní oxidačně-redukční reakce elektrochemická buňka; hmotnost aktivní elektrody se mění v průběhu oxidačně-redukční reakce anoda elektroda v elektrochemickém článku, na které dochází k oxidaci; informace o anoda je zaznamenán na levé straně soli most v buňce zápis katoda elektroda v elektrochemickém článku, na které snížení dochází; informace o katoda je zaznamenán na pravé straně soli most v buňce zápis, buněk notace zjednodušený způsob, jak reprezentovat reakce v elektrochemickém článku mobilní potenciální rozdíl v elektrický potenciál, který vzniká při různých kovů jsou spojeny; hnací silou pro tok náboje (proudu) v oxidačně-redukční reakce, galvanický článek elektrochemický článek, který zahrnuje spontánní oxidace-redukční reakce; elektrochemické články s pozitivní buňky potenciály; také nazývá fotovoltaické buňky inertní elektroda elektroda, která umožňuje průchod proudu, ale to neznamená, jinak účastní oxidačně-redukční reakce v elektrochemickém článku; hmotnost inertní elektrody nemění během oxidačně-redukční reakce; inertní elektrody jsou často vyrobeny z platiny nebo zlata, protože tyto kovy jsou chemicky nereaktivní. fotovoltaické buňky jiný název pro galvanické buňky
Přispěvatelé a Pravomocí
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) a Richard Langley (Stephen F. Austin State University) s přispívajících autorů. Obsah učebnice produkovaný OpenStax College je licencován pod licencí Creative Commons Attribution License 4.0. Stáhnout zdarma na http://cnx.org/contents/85abf193-2bd…[email protected]).