hybridizace teorie je často viděn jako dlouhý a matoucí pojem, a to je šikovný dovednost být schopen rychle zjistit, zda atom je sp3, sp2 nebo sp, aniž by museli jít přes všechny podrobnosti o tom, jak hybridizace se stalo.
naštěstí existuje zkratka a v tomto příspěvku se pokusím shrnout to v několika odlišných krocích, které musíte dodržovat.
řekněme, budete vyzváni k určení hybridizace státu za očíslované atomy v následující molekuly:

první věc, kterou musíte udělat, je určit počet skupin, které jsou na každém atomu. Skupinami máme na mysli buď atomy, nebo osamělé páry elektronů. Toto je také známé jako sterické číslo (SN).

Níže jsou uvedeny některé příklady stérické čísla 2-4, což je do značné míry to, co potřebujete vědět v organické chemii:

Všimněte si, že na více vazbách nezáleží, jedná se o atomy + osamělé páry pro jakýkoli typ vazby.
Jakmile budete vědět, jak určit stérické číslo (to je z teorie VSEPR), stačí použít následující korelace:
Pokud stérické číslo je 4, to je sp3
Pokud stérické číslo je 3 – sp2,
Pokud stérické číslo je 2 – sp
Takže teď, pojďme zpět k naší molekule a určit hybridizace státy pro všechny atomy.
C1 – SN = 3 (tři atomy spojeny), tudíž je sp2,
C2 – SN = 3 (tři atomy spojeny), tudíž je sp2,
O4 – SN = 3 (1 atom + 2 osamělé páry), proto je sp2,
O5 – SN = 4 (2 atomy + 2 osamělé páry), proto je sp3
C6 – SN = 4 (4 atomy), proto je sp3
C7 – SN = 4 (4 atomy), proto je sp3
N8 – SN = 4 (3 atomy + 1 osamělý pár), proto je sp3
C9 – SN = 2 (2 atomy), proto je sp
C10 – SN = 2 (2 atomy), proto je sp

kromě tato metoda je také velmi užitečná pro zapamatování některých vlastností souvisejících se strukturou a hybridizací. Obecně platí, že atom se všemi jednoduchými vazbami je SP3 hybridizovaný. Nejlepším příkladem jsou alkany. Všechny atomy uhlíku v alkanu jsou SP3 hybridizovány s čtyřstěnnou geometrií.
uhlíky v alkenech a dalších atomech s dvojnou vazbou jsou často SP2 hybridizovány a mají trigonální rovinnou geometrii.
trojné vazby, na druhou stranu, je charakteristické pro alkynů, kde atomy uhlíku jsou sp-hybridizovány.
Existuje několik častých výjimek, co jsme diskutovali o určení hybridizace státu, a oni jsou většinou souvisí s metodou, kde se podíváme na lepení typ atomu.
například v oxidu uhličitém (CO2) má uhlík dvě dvojné vazby, ale je Sp-hybridizovaný.
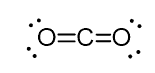
A důvodem pro to je skutečnost, že stérické číslo uhlíku je dva (tam jsou jen dva atomy kyslíku k němu připojen) a s cílem udržet dva atomy na 180o, což je optimální geometrie, uhlíku musí použít dvou stejných orbitalů. To je možné pouze v hybridizaci sp. Další dva 2p orbitaly se používají pro výrobu dvojných vazeb na každé straně uhlíku.
dalším běžným a velmi důležitým příkladem jsou karbokace.

zde má uhlík pouze jednotlivé vazby a může vypadat, že má být SP3 hybridizován. Uhlík v těchto typech karbokationů je však hybridizován sp2. Opět ze stejného důvodu, že jeho sterické číslo je 3 (sp2-tři identické orbitaly).
výjimka z metody Sterického čísla
jednou výjimkou se sterickým číslem jsou například amidy. Atom dusíku zde má sterické číslo 4 a očekává se, že sp3. Nicméně, protože rezonance přemístění výroby z osamělé dvojice, to interconverts z sp3 na sp2, protože to je jediný způsob, jak mít elektrony v uspořádané p orbitalu, které se mohou překrývat a podílet se v rezonanční stabilizaci s pí vazba elektronů C=O dvojné vazby.

Ve většině případů, nebudete muset starat o výjimky, pokud jdete na základě Stérické Číslo.