k delokalizaci dochází, když je elektrický náboj rozložen na více než jeden atom. Například vazebné elektrony mohou být rozděleny mezi několik atomů, které jsou spojeny dohromady.

Příklad 1:
Jedním z nejznámějších příkladů molekuly, v nichž vazebné elektrony jsou delokalizována je benzen, je uvedeno níže:
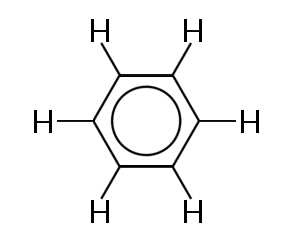
Benzen se skládá z kruhu šesti atomy uhlíku, atomu. Atomy uhlíku jsou všechny SP2 hybridizovány s jedním nehybridizovaným P orbitalem.
hybridní orbitaly sp2 produkují normální kovalentní vazby, někdy nazývané σ-vazby: jedná se o jednoduché vazby C-C a jednotlivé vazby C-H.
to ponechává každý uhlík s elektronem v p orbitalu v pravém úhlu k rovině kruhu.
v níže uvedeném diagramu vlevo vidíte orbitaly sp2 tvořící kovalentní vazby. Vpravo můžete vidět orbitaly p, z nichž každý obsahuje elektron.
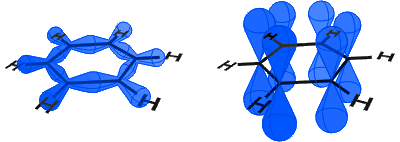
p-orbitaly kombinovat straně a elektrony, v p orbitalech jsou popsány jako π-elektrony.
v níže uvedeném diagramu se orbitaly p kombinovaly a π-elektrony jsou delokalizovány. V průměru jsou všechny prstencové vazby identické.
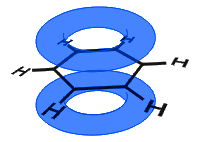
na Rozdíl od v dalším příkladu níže, delokalizována elektronů v benzenu jsou drženy v molekule a nejsou volně pohybovat přes sypkého materiálu.
příklad 2:
Kovy mají vysokou tepelnou a elektrickou vodivost, protože nejvzdálenější elektrony v jejich atomy jsou delokalizována. Tyto elektrony nejsou spojeny s žádným konkrétním kovovým jádrem, a tak se mohou volně pohybovat po celém kovu.
potvrzení: modré barevné obrazy benzenových orbitalů jsou s laskavým svolením Sansculotte. Tyto obrázky jsou licencovány pod licencí Creative Commons Attribution-Share Alike 1.0 Generic license.