fotovoltaickými buňky, často známý jako galvanický článek, poskytuje elektrickou energii. Zdrojem této energie je spontánní chemická reakce, konkrétněji spontánní redoxní reakce.
například, všechny baterie jsou vyrobené z jednoho nebo více fotovoltaických článků;baterie se vybíjejí, kdy většina nebo všechny své reaktanty byly převedeny na produkty, mění jejich chemické potenciální energie na elektrickou energii.
Fotovoltaické Články – Základní Postup
Chemické Potenciální Energie → Elektrická Energie
fotovoltaických buněk je jedním ze dvou základních typů, z elektrochemické buňky.Druhý typ je elektrolytické buňky; v elektrolytické cele, elektrická energie se používá k pohonu non-spontánní chemické reakce.Například voda může být rozdělena na vodík a kyslík v elektrolytické buňce. Také při dobíjení dobíjecí baterie funguje jako elektrolytický článek.
Základní Fotovoltaické Buňky Schéma

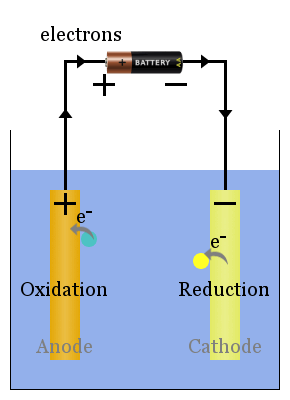
Spontánní redoxní reakce na elektrody produkují napětí.Správně nastavit, toto napětí může řídit elektronů přes elektrických zařízení, jako jsou žárovky je znázorněno zde.V tomto diagramu, druhy přenosu elektronů na anodu, odkud proudí přes žárovku ke katodě, kde přinášejí o snížení.
Základní Elektrolytické Cely Schéma
Non-spontánní redoxní reakce jsou řízeny externí napětí.Procesy elektrolytické buňky jsou opakem voltaických článků. proud ze zdroje energie tlačí elektrony na katodu, kde způsobují redukci druhů.
Přečtěte si více zde o katodách a anodách ve voltaických vs elektrolytických článcích.
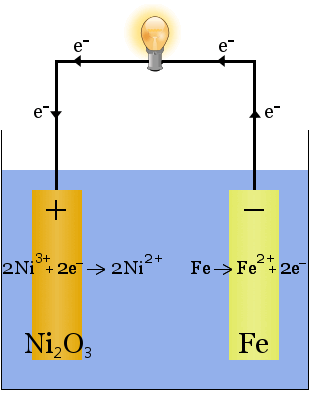
Příklad Fotovoltaické Buňky
Edison Baterie
Edison baterie je jednoduché, dobíjecí mobilní vynalezl Thomas Edison.Skládá se ze dvou kovových elektrod, jeden ze železa, druhá z niklu.Během počátečního nabíjení se na niklové elektrodě vytvoří povlak oxidu nikelnatého.
elektrolytů (iontové kapaliny mezi elektrodami) je 20 až 30 procent hmotnostních hydroxidu draselného ve vodě.Úlohou hydroxidu draselného je v tomto případě zvýšit iontovou vodivost pro dokončení elektrického obvodu-hydroxid draselný se při reakci nespotřebovává.
Když se vybíjí, Edisonova buňka pracuje jako voltaická buňka.Když se nabíjí, buňka pracuje jako elektrolytická buňka.
chemické rovnice pro reakce na elektrodách jsou:
Při vypouštění, kdy buňka je dodávání elektrické energie, reakce nad pokračujte vpravo →.
během nabíjení, kdy článek přeměňuje elektrickou energii na chemickou potenciální energii, probíhají výše uvedené reakce doleva ←.
Edison buněk, s oběma elektrodami sdílení stejného elektrolytu, je jedním z nejjednodušších fotovoltaických buněk v praktické využití; většina voltaických článků je komplikovanější.Jeho velkými výhodami jsou pozoruhodná robustnost proti chybám, jako je přebíjení a velmi dlouhá životnost, s téměř neomezenou cyklováním náboje a vybití.
jeho největší nevýhodou je, že vzhledem k jeho energetickému výkonu je velmi těžký.
Další Příklad:
Lithiové Baterie
Pokrok v technologii baterií řízené miniaturizace elektronických zařízení.Bez těchto pokroků by moderní zařízení, jako jsou mobilní telefony a tablety, byla větší a těžkopádnější.
jádrem těchto pokroků byla lithium-iontová technologie.Prvek lithium je kov s velmi nízkou hustotou: při 0,534 g/cm3 je lithium o polovinu hustší než voda; lithium plave na vodě.Porovnejte to s kovy v Edisonově buňce, hustota niklu je 8,908 g/cm3 a železo je 7,874 g / cm3: jsou více než 10x vyšší než hustota lithia.
vysoký redoxní potenciál lithia v kombinaci s nízkou hustotou činí jeho ionty ideální pro použití jako materiál baterie.
typická lithium-iontová baterie je založena na porézních elektrodách, které umožňují iontům Li pohybovat se dovnitř a ven z pórů.Například, dobíjecí lithium-iontová baterie by mohla mít grafitové elektrody a lithium dopovaného oxidu kobaltu elektroda s polyetylénový elektrolytu obsahující soli LiPF6.
když taková baterie pohání zařízení, atomy lithia držené ve struktuře vrstvy grafitové anody se oxidují, aby se staly ionty.
na katodě jsou ionty lithia redukovány uvnitř struktury oxidu kobaltu.
These reactions are reversed when the cell is being charged.
