Generic Name: heparin sodný
Léková Forma: injekční
- Hep-Lock Popis
- Hep-Lock – Klinická Farmakologie
- Indikace a Využití pro Hep-Lock
- kontraindikace
- upozornění
- hypersenzitivita
- krvácení
- trombocytopenie
- Heparinem indukované Trombocytopenie (HIT) a Heparinem indukované Trombocytopenie a Trombózou (HITT)
- opožděný nástup HIT a HITT
- Použití u Novorozenců a Kojenců
- bezpečnostní Opatření
- Obecné
- Laboratorní Testy
- lékové Interakce
- Karcinogeneze, Mutageneze, Poškození Fertility
- Těhotenství
- Těhotenství Kategorie C
- kojící matky
- pediatrické použití
- geriatrické použití
- nežádoucí účinky
- krvácení
- trombocytopenie, heparinem indukovaná trombocytopenie (HIT) a heparinem indukovaná trombocytopenie a trombóza (HITT) a opožděný nástup HIT a HITT
- lokální podráždění
- Přecitlivělost
- předávkování
- příznaky
- Léčba – Neutralizace Heparinu Efekt
- heparin Dávkování a způsob Podání
- Údržba Průchodnost Intravenózní Zařízení
- Odebrání Vzorků Krve
- Jak je Hep-Lock Dodávané
- Ukládání
Hep-Lock Popis
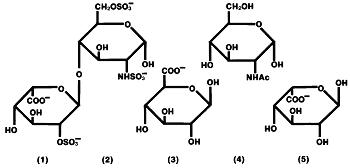
Heparin je heterogenní skupina nerozvětvené aniontových mukopolysacharidů, tzv. glykosaminoglykanů, které mají antikoagulační vlastnosti. I když ostatní mohou být přítomny, hlavní cukry vyskytující se v heparinu jsou: (1) α-L-iduronických kyselina 2-sulfát, (2) 2-deoxy-2-sulfamino-α-D-glukóza-6-sulfát, (3) β-D-glukuronové kyseliny, (4) 2-acetamido-2-deoxy-α-D-glukózy a (5) α-L-iduronických kyseliny. Tyto cukry jsou přítomny v sestupném množství, obvykle v pořadí, v (2)>>>>(5), a jsou spojeny glykosidickými vazbami, které tvoří polymery různých velikostí. Heparin je silně kyselý kvůli obsahu kovalentně vázaných sulfátových a karboxylových kyselin. V heparinu sodném jsou kyselé protony síranových jednotek částečně nahrazeny sodnými ionty.
strukturní vzorec heparinu sodného (reprezentativní podjednotky):
Hep-Zámek U/P (Konzervační Heparin Zámku Flush Řešení, USP) je sterilní roztok pro intravenózní flush. Nepoužívá se k antikoagulační terapii. Hep-Lock U / P je speciálně navržen pro použití v situacích, kdy není vhodné používat konzervační látky. Každý mL obsahuje heparin sodný 10 nebo 100 USP jednotek, odvozených z prasečího střeva a standardizován pro použití jako antikoagulant, chloridu sodného, 8 mg, monohydrát dihydrogenfosforečnanu sodného 2.3 mg, hydrogenfosforečnan sodný bezvodý 0,5 mg ve Vodě na Injekci. pH 5,0-7.5. Účinnost je stanovena biologickým testem pomocí referenčního standardu USP založeného na jednotkách heparinové aktivity na miligram.
Hep-Lock – Klinická Farmakologie
Heparin inhibuje reakce, které vedou ke srážení krve a tvorbě fibrinové sraženiny in vitro a in vivo. Heparin působí na více místech v normálním koagulačním systému. Malé množství heparinu v kombinaci s antitrombinem III (heparinový kofaktor) může inhibovat trombózu inaktivací aktivovaného faktoru X a inhibicí přeměny protrombinu na trombin. Jakmile se vyvinula aktivní trombóza, větší množství heparinu může inhibovat další koagulaci inaktivací trombinu a zabráněním přeměny fibrinogenu na fibrin. Heparin také zabraňuje tvorbě stabilní fibrinové sraženiny inhibicí aktivace faktoru stabilizujícího fibrin.
doba krvácení není heparinem obvykle ovlivněna. Doba srážení je prodloužena plnými terapeutickými dávkami heparinu; ve většině případů není měřitelně ovlivněna nízkými dávkami heparinu. Loglineární grafy plazmatických koncentrací heparinu s časem, pro široký rozsah hladin dávky, jsou lineární, což naznačuje nepřítomnost procesů nulového řádu. Játra a retikuloendoteliální systém jsou místy biotransformace. Dvoufázová eliminační křivka, rychle klesající alfa fáze (t½ = 10 min) a po dosažení věku 40 let pomalejší beta fáze, indikuje absorpci v orgánech. Absence vztahu mezi antikoagulačním poločasem a poločasem koncentrace může odrážet faktory, jako je vazba heparinu na proteiny.
Pacienti nad 60 let věku, na základě podobných dávek heparinu, může mít vyšší plazmatické hladiny heparinu a delší aktivovaný parciální tromboplastinový krát (APTTs) ve srovnání s pacienty pod 60 let věku.
Heparin nemá fibrinolytickou aktivitu; proto nebude lýzovat existující sraženiny.
Indikace a Využití pro Hep-Lock
Hep-Zámek U/P (Konzervační Heparin Zámku Flush Řešení, USP) je určena k udržení průchodnosti přebývající venepunkční přístroje určené pro přerušovaný přípravu injekční nebo infuzní terapii nebo při odběru krve. Heparin Lock Flush roztok může být použit po počátečním umístění zařízení do žíly, po každé injekci léku nebo po vysazení krve pro laboratorní testy. (Návod k použití viz dávkování a podávání, udržování průchodnosti intravenózních prostředků.
Hep-Lock U / P se nepoužívá pro antikoagulační terapii.
kontraindikace
Heparin sodný by neměl být používán u pacientů s následujícími stavy: těžká trombocytopenie; nekontrolovatelný stav aktivního krvácení (viz varování), s výjimkou případů, kdy je to způsobeno diseminovanou intravaskulární koagulací.
upozornění
Heparin není určen k intramuskulárnímu podání.
hypersenzitivita
pacienti s dokumentovanou přecitlivělostí na heparin by měli dostávat lék pouze v jasně život ohrožujících situacích. (Viz nežádoucí účinky, hypersenzitivita.
krvácení
krvácení se může objevit prakticky na jakémkoli místě u pacientů užívajících heparin. Nevysvětlitelný pokles hematokritu, pokles krevního tlaku nebo jakýkoli jiný nevysvětlitelný příznak by měl vést k vážnému zvážení hemoragické události.
Heparin sodný by měl být používán s velkou opatrností v chorobných stavech, ve kterých existuje zvýšené nebezpečí krvácení. Některé z podmínek, při kterých existuje zvýšené nebezpečí krvácení, jsou:
kardiovaskulární
subakutní bakteriální endokarditida, těžká hypertenze.
chirurgické
během a bezprostředně po (a) spinální anestezii nebo spinální anestezii nebo (b) velké operaci, zejména zahrnující mozek, míchu nebo oko.
hematologické stavy spojené se zvýšenými tendencemi ke krvácení, jako je hemofilie, trombocytopenie a některé vaskulární purpury. gastrointestinální
ulcerativní léze a kontinuální drenáž žaludku nebo tenkého střeva.
jiné
menstruace, onemocnění jater s poruchou hemostázy.
trombocytopenie
trombocytopenie byla hlášena u pacientů užívajících heparin s hlášenou incidencí až 30%. Počet krevních destiček by měl být získán na začátku a pravidelně během podávání heparinu. Mírná trombocytopenie (počet vyšší než 100 000 / mm3) může zůstat stabilní nebo zvrátit, i když heparin pokračuje. Trombocytopenie jakéhokoli stupně by však měla být pečlivě sledována. V případě, že počet klesne pod 100 000/mm3, nebo-li recidivující trombóza se vyvíjí (viz Heparinem indukované Trombocytopenie a Heparinem indukované Trombocytopenie a Trombózy), heparin produktu by měla být ukončena a, pokud je to nutné, alternativní antikoagulační podáván.
Heparinem indukované Trombocytopenie (HIT) a Heparinem indukované Trombocytopenie a Trombózou (HITT)
Heparinem indukované Trombocytopenie (HIT) je závažný protilátkami zprostředkované reakce vyplývající z ireverzibilní agregace krevních destiček. HIT může vést k rozvoji žilních a arteriálních trombóz, což je stav označovaný jako heparinem indukovaná trombocytopenie a trombóza (HITT). Trombotické příhody mohou být také počáteční prezentací HITT. Tyto závažné tromboembolické příhody patří hluboká žilní trombóza, plicní embolie, mozkové žilní trombózy, ischemie končetiny, cévní mozkové příhody, infarktu myokardu, mezenterické trombózy, renální arteriální trombóza, nekróza kůže, gangréna končetin, které může vést k amputaci, a možná i smrt. Trombocytopenie jakéhokoli stupně by měla být pečlivě sledována. Pokud počet trombocytů klesne pod 100 000/mm3, nebo-li recidivující trombóza se vyvíjí, heparin by měl být přípravek okamžitě vysazen a alternativních antikoagulancií považovat, pokud pacienti vyžadují pokračující antikoagulační léčba.
opožděný nástup HIT a HITT
heparinem indukovaná trombocytopenie a heparinem indukovaná trombocytopenie a trombóza se mohou objevit až několik týdnů po přerušení léčby heparinem. Pacienti s trombocytopenií nebo trombózou po vysazení heparinu by měli být vyšetřeni na HIT a HITT.
Použití u Novorozenců a Kojenců
100 jednotek/mL koncentrace by neměl být používán u novorozenců nebo u dětí, které váží méně než 10 kg kvůli riziku systémové antikoagulace. Opatrnost je nutná při použití koncentrace 10 jednotek / mL u předčasně narozených dětí s hmotností nižší než 1 kg, kteří dostávají časté návaly, protože terapeutická dávka heparinu může být podána kojenci během 24 hodin.
bezpečnostní Opatření
Obecné
Opatření musí být věnována, pokud léky, které jsou neslučitelné s heparinem se podává přes zavedenou intravenózní katétr obsahující Konzervační Heparin Zámku Flush Řešení. (Osivo a podávání, udržování průchodnosti intravenózních prostředků.) Koncentrace fosforu v roztoku heparinu je 0,63 mg / ml.
Trombocytopenie, Heparinem indukované Trombocytopenie (HIT) a Heparinem indukované Trombocytopenie a Trombózou (HITT)
SeeWARNINGS
Zvýšené Riziko pro Starší Pacienty, Zejména Ženy
vyšší výskyt krvácení bylo hlášeno u pacientů, zejména žen, nad 60 let věku.
Laboratorní Testy
Pravidelné krevních destiček, hematocrits, a testy na okultní krvácení ve stolici se doporučuje během celého průběhu terapie heparinem, bez ohledu na způsob podání. (Výsev a podání semen.)
lékové Interakce
Inhibitory krevních Destiček
Léky, jako je kyselina, dextran, fenylbutazon, ibuprofen, indometacin, dipyridamol, hydroxychlorochin a další, které zasahují do krevních destiček-agregace reakce (hlavní hemostatické obrany heparinizovaný pacientů) může vyvolat krvácení a měl by být používán s opatrností u pacientů užívajících heparin sodný.
Jiné Interakce
Digitalis, tetracykliny, nikotin nebo antihistaminika mohou částečně působit proti antikoagulační účinek heparinu sodného.
Karcinogeneze, Mutageneze, Poškození Fertility
Žádné dlouhodobé studie u zvířat nebyly provedeny pro vyhodnocení karcinogenního potenciálu heparin sodný. Rovněž nebyly provedeny žádné reprodukční studie na zvířatech týkající se mutageneze nebo poškození fertility.
Těhotenství
Teratogenní Účinky
Těhotenství Kategorie C
reprodukční studie na Zvířatech nebyly provedeny s heparinem sodným. Není také známo, zda heparin sodný může při podávání těhotné ženě způsobit poškození plodu nebo může ovlivnit reprodukční schopnost. Heparin sodný by měl být podáván těhotné ženě pouze v případě, že je to nezbytně nutné.
Neteratogenní účinky
Heparin neprochází placentární bariérou.
kojící matky
Heparin se nevylučuje do mateřského mléka.
pediatrické použití
bezpečnost a účinnost u dětských pacientů nebyla stanovena (Viz Upozornění, použití u novorozenců a kojenců).
geriatrické použití
u pacientů starších 60 let, zejména u žen, byl hlášen vyšší výskyt krvácení (viz Klinická farmakologie a opatření obecně).
nežádoucí účinky
krvácení
krvácení je hlavní komplikací, která může vyplynout z užívání heparinu(vizvarnění, krvácení). Příliš prodloužená doba srážení nebo menší krvácení během léčby může být obvykle kontrolována stažením léku(viz předávkování).
trombocytopenie, heparinem indukovaná trombocytopenie (HIT) a heparinem indukovaná trombocytopenie a trombóza (HITT) a opožděný nástup HIT a HITT
Vizwarnings.
lokální podráždění
lokální podráždění a erytém byly hlášeny při použití roztoku heparinu Lock Flush.
Přecitlivělost
Generalizované reakce z přecitlivělosti byly hlášeny, s zimnice, horečka a kopřivka jako nejvíce obvyklé projevy, astma, rýma, slzení, bolest hlavy, nevolnost a zvracení, a anafylaktoidní reakce, včetně šoku, vyskytující se vzácněji. Může se objevit svědění a pálení, zejména na plantární straně nohou.
trombocytopenie byla hlášena u pacientů užívajících heparin s hlášenou incidencí až 30%. Zatímco často mírné a žádný zřejmý klinický význam, jako je trombocytopenie, mohou být doprovázeny těžkou tromboembolických komplikací, jako jsou kožní nekrózy, gangrény končetin, které může vést k amputaci končetin, infarkt myokardu, plicní embolie, mrtvice, a možná i smrt. (Viz Upozornění a opatření.)
některé epizody bolestivých, ischemických a kyanozovaných končetin byly v minulosti připisovány alergickým vazospastickým reakcím. Zda jsou ve skutečnosti totožné s komplikacemi spojenými s trombocytopenií, je třeba určit.
předávkování
příznaky
krvácení je hlavním příznakem předávkování heparinem. Krvácení z nosu, krev v moči nebo dehtovitá stolice mohou být zaznamenány jako první známky krvácení. Snadné podlitiny nebo petechiální formace mohou předcházet upřímnému krvácení.
Léčba – Neutralizace Heparinu Efekt
Při klinických okolností (krvácení) vyžadují obrácení heparinizaci, protamin-sulfát (1% roztok) formou pomalé infuze bude neutralizovat heparin sodný. Ne více než 50 mg by mělo být podáváno velmi pomalu, v jakémkoli 10minutovém období. Každá mg protamin sulfátu neutralizuje přibližně 100 jednotek heparinu USP. Požadované množství protaminu se časem snižuje, protože heparin je metabolizován. Přestože je metabolismus heparinu složitý, může se za účelem výběru dávky protaminu předpokládat poločas přibližně 1/2 hodiny po intravenózní injekci.
podávání protamin sulfátu může způsobit závažné hypotenzní a anafylaktoidní reakce. Protože fatální reakce, často připomínající anafylaxe byly hlášeny, lék by měl být podáván pouze tehdy, když resuscitační techniky a léčbu anafylaktické šoku jsou snadno dostupné.
Další informace naleznete v označení injekce protamin sulfátu, produktů USP.
heparin Dávkování a způsob Podání
Parenterálně podávané léčivé přípravky je nutno před podáním vizuálně zkontrolovat na výskyt částic a změny barvy před podáním, kdykoli to roztok a kontejner dovolují. Mírné zabarvení nemění účinnost.
Konzervační Heparin Zámku Flush Řešení v 100 jednotek/mL koncentrace se nedoporučuje pro použití u novorozenců a kojenců (viz VAROVÁNÍ, Použití U Novorozenců a Kojenců).
Údržba Průchodnost Intravenózní Zařízení
Aby se zabránilo tvorbě sraženin v heparinu zámku nastavit nebo centrálního žilního katetru po jeho správném vložení, Heparin Zámku Flush Řešení, USP se vstřikuje pomocí injekční hub v množství dostatečném, aby zaplnil celé zařízení. Toto řešení by mělo být vyměněno při každém použití zařízení. Před podáním jakéhokoli roztoku přes zařízení odsajte, abyste potvrdili průchodnost a umístění hrotu jehly nebo katétru. Pokud je lék podáván je neslučitelné s heparinem, celé zařízení by mělo být propláchnout fyziologickým roztokem před a po léčení je podáván; po druhé fyziologického roztoku, Heparin Zámku Flush Řešení, USP může být reinstilled do zařízení. Podrobnosti týkající se jeho použití by měly být konzultovány s pokyny výrobce zařízení. Obvykle tento zředěný roztok heparinu udržuje antikoagulaci v zařízení po dobu až 4 hodin.
Poznámka: Vzhledem k tomu, že opakované injekce malých dávek heparinu mohou změnit testy aktivovaného parciálního tromboplastinového času (APTT), je třeba před zavedením intravenózního zařízení získat výchozí hodnotu pro APTT.
Odebrání Vzorků Krve
Konzervační Heparin Zámku Flush Řešení, USP může být také použit po každém odebrání krve pro laboratorní testy. Když heparin by narušit nebo ovlivnit výsledky krevních testů, heparin řešení by měly být vymazány ze zařízení nasávací a odhazovat ji před odebráním vzorku krve.
Jak je Hep-Lock Dodávané
Hep-Zámek U/P (Konzervační Heparin Zámku Flush Řešení, USP)
10 USP jednotek/mL
1 mL DOSETTE lahviček balené v 25s (NDC 0641-0272-25)
USP 100 jednotek/mL
1 mL DOSETTE lahviček balené v 25s (NDC 0641-0273-25)
Ukládání
Skladujte při 20°-25°C (68°-77°F) .
- Tahata T, Shigehito M, Kusuhara K, Ueda Y, et al. Opožděný nástup heparinem indukované trombocytopenie-kazuistika – J Jpn Assn Torca Surg. 1992; 40 (3): 110-111.
- Warkentin T, Kelton J. Trombocytopenie a trombóza vyvolaná opožděným nástupem heparinem. Annals of Internal Medicine. 2001;135:502-506.
- Rice L, Attisha W, Drexler A, Francis J. trombocytopenie vyvolaná heparinem se zpožděným nástupem. Annals of Internal Medicine, 2002; 136: 210-215.
- Dieck J., C. Rizo-Patron, et al. (1990). „Nová alternativa projevu a léčby trombózy vyvolané heparinem.” Hruď.1990;98:1524-26.
- Smythe M, Stephens J, Mattson. Trombocytopenie Vyvolaná Opožděným Nástupem Heparinem. Annals of Emergency Medicine, 2005;45(4):417-419.
- Divgi a. (dotisk), Thumma s., Hari P., Friedman k., opožděný nástup heparinem indukovaná trombocytopenie (HIT) představující se po expozici Nezdokumentovaného léčiva jako Postangiografická plicní embolie. Krev. 2003;102(11):127b.
ESI logo, Hep-Zámek a Dosette jsou registrované ochranné známky společnosti Baxter International, Inc., nebo její dceřiné společnosti.
Vyrábí
Baxter Healthcare Corporation,
Deerfield, IL 60015 spojené státy
Dotaz na Produkt 1 800 ANA DROG (1-800-262-3784)
MLT-00090/6.0
| Hep-Lock U/P heparin sodium injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
| Hep-Lock U/P heparin sodium injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Baxter Healthcare Corporation
Medical Disclaimer