US Pharm. 2008; 33 (4) (onkologická suppl): 20-30.
abstrakt: přibližně 75% postmenopauzálních žen s rakovinou prsu má onemocnění pozitivní na hormonální receptor (HR+).1 Tamoxifen byl standardem léčby rakoviny prsu HR+ u postmenopauzálních žen až do příchodu selektivních inhibitorů aromatázy třetí generace, kterými jsou anastrozol, letrozol a exemestan.3,4 Tyto látky prokázaly lepší nemoc-free survival v klinických studiích v porovnání s tamoxifenem, ale jejich prospěchu, když se používá déle než pět let u postmenopauzálních žen s HR+ rakovinou prsu nebyla prokázána.3,4
bylo odhadnuto, že tři čtvrtiny postmenopauzálních žen s rakovinou prsu mají onemocnění pozitivní na hormonální receptor (HR+).1 Tamoxifen-selektivní modulátor estrogenových receptorů s estrogenními účinky na kosti, endometriální tkáň a lipidy a anti!= estrogenní účinky na prsní tkáň – byla standardní léčba rakoviny prsu HR + u postmenopauzálních žen až do zavedení selektivních inhibitorů aromatázy třetí generace (AIs).2-4 tyto látky-anastrozol, letrozol a exemestan-prokázaly vynikající přežití bez onemocnění (DFS) ve srovnání s tamoxifenem v klinických studiích.3,4 Nežádoucí účinky spojené s použitím tamoxifen–endometriální rakoviny, tromboembolické komplikace, a tamoxifen odpor-podporovat vývoj terapií s odlišným mechanismem účinku, jako je AIs.2
viz tabulka 1 pro shrnutí důležitých informací o AIs třetí generace.
Pozadí
Skotský chirurg George Beatson popsal hormonální příspěvek estrogenů na karcinogeneze v souvislosti s rakovinou prsu v 1896.5 Beatson uznal, že odstranění vaječníků (ovarektomie) bylo prospěšné u žen s neoperovatelnou rakovinou prsu.5 Tento chirurgicky indukovaný stav deprivace estrogenu přispěl k inhibici růstu nádoru v buňkách rakoviny prsu u žen s HR + onemocněním. 5
Aminoglutethimid, původně formulovány jako antikonvulzivní agent, byl první, nespecifické AI zpočátku podporoval v pozdní 1970 jako druhá-line agent následující tamoxifen u postmenopauzálních žen s pokročilým HR+ karcinomu prsu.6 toxické vedlejší účinky, jako je suprese nadledvin a nutnost léčby steroidy, vedly k stažení aminoglutethimidu z trhu.6 U postmenopauzálních žen s časnou a pozdní fázi HR+ karcinomu prsu, třetí generace AIs prokázat lepší profil toxicity, větší selektivitu, vyšší účinnost a lepší klinická účinnost ve srovnání se staršími látkami. 6
Classification4,7
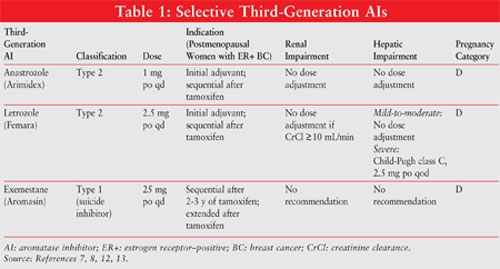
AIs jsou klasifikovány jako typ 1, steroidní (nesoutěžní, nevratný) nebo typu 2, nesteroidní (kompetitivní, reverzibilní) inhibitory. Exemestan, inhibitor typu 1, se nevratně váže na místo na molekule aromatázy a je známý jako sebevražedný inhibitor. Inhibitory typu 2 anastrozol a letrozol se reverzibilně vážou na aromatázu. Viz obrázek 1 pro chemické struktury různých AIs.
Mechanismus účinku
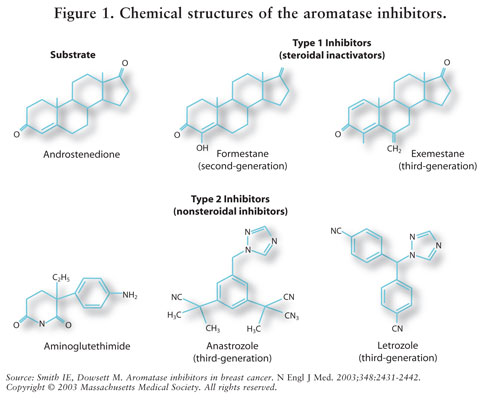
Syntézy estrogenů je zprostředkován enzymem aromatázy.7 aromatáza převádí androstendion a testosteron na estron a estradiol.5,7 AIs snižuje estrogen u postmenopauzálních žen, čímž inhibuje jeho karcinogenní účinek na prsní tkáň.7, Protože vaječníky před menopauzou ženy jsou stále funkční, AIs nejsou uvedena pro tuto populaci mimo klinické studie; u těchto žen, AIs by stimulovat hypotalamus a hypofýzu zvýšit produkci gonadotropinů.4 viz obrázek 2.
Toxicities6,8
Nežádoucí účinky AIs patří kardiovaskulární dysfunkce, jako je hypertenze, vazodilatace, edém a bolest na hrudi. K vyhodnocení plného účinku AIs na srdeční funkci je nutná další studie. Pacienti mohou zaznamenat snížení kostní minerální hustoty (BMD), zvýšené riziko vzniku zlomenin, vazomotorické příznaky, suchost pochvy, bolesti pohybového systému, bolesti hlavy, nespavost, deprese, zvýšená kašel, dušnost, gastrointestinální potíže, zvýšení tělesné hmotnosti, a možná zvýšené hladiny lipidů. Úbytek kostní hmoty je převládajícím vedlejším účinkem; bisfosfonáty, jako je kyselina zoledronová, byly použity k potlačení. Pacienti na AIs by měli dostávat suplementaci vitamínem D a vápníkem. Prodloužené nežádoucí účinky a účinky na kognitivní funkce z terapie AI dosud nebyly stanoveny.9 AI je kontraindikováno u těhotných žen.
lékové Interakce
Anastrozol inhibuje CYP1A2, CYP2C9 a CYP3A4.10,11 Letrozol je metabolizován CYP2C19, CYP2A6 a, a exemestan CYP3A4 metabolizuje.8,10-13 Induktory CYP3A4, jako jsou rifampicin, fenytoin, karbamazepin, třezalka tečkovaná může způsobit snížení exemestan úrovně, pokud je podáván současně. 8,12,13 Tamoxifen způsobuje při současném podávání 38% pokles letrozolu a 27% pokles anastrozolu.2,7,8,14
Indikace a Dávkování
Anastrozol 10,11: Anastrozolu 1 mg jednou denně je indikován u časného karcinomu prsu jako počáteční adjuvantní terapie u postmenopauzálních žen s hormonálně senzitivní onemocnění a jako první linka pro HR+ nebo HR-neznámý metastatického nebo lokálně pokročilého onemocnění. Je také schválen pro použití po léčbě tamoxifenem u žen s progresivním onemocněním. Úprava dávky není nutná u poruchy funkce ledvin nebo mírné až středně závažné poruchy funkce jater.
Letrozole11, 12: Letrozol 2.5 mg jednou denně, je indikována u postmenopauzálních žen s HR+ rakovinou prsu v raném stádiu jako počáteční terapie, nebo jako prodloužené adjuvantní terapie po tamoxifen. Je také indikován pro HR+ nebo HR-neznámé metastatické onemocnění. U těžké poruchy funkce jater se doporučuje úprava dávky.
Exemestane11,14: Exemestan 25 mg p. o. jednou denně je indikován jako adjuvantní léčba dva až tři roky po tamoxifen u postmenopauzálních žen s HR+ časným karcinomem prsu, pro celkem pěti po sobě jdoucích let hormonální terapii. Může být také použit pro onemocnění, které pokročilo po léčbě tamoxifenem. Mělo by se užívat po jídle. Úprava dávky je zbytečné pro poškození jater nebo ledvin
Klinické Studie
Tamoxifen týkající se toxicity jako je rakovina endometria výzvy zahájení rozsáhlé klinické studie zkoumající využití třetí generace AIs u postmenopauzálních žen s HR+ karcinomu prsu. K posouzení účinnosti těchto látek ve srovnání s tamoxifenem byly použity různé zkušební návrhy.6 vynikající výsledky z hlediska klinické účinnosti a profilů toxicity zavedené AIs jako nový standard adjuvantní terapie u postmenopauzálních žen s rakovinou prsu HR+.6
ATAC15: ATAC (Arimidex, Tamoxifen Samostatně nebo v Kombinaci), multicentrické, randomizované, dvojitě zaslepené studii, ve srovnání třech ramenech: tamoxifen 20 mg + anastrozol placebo, anastrozol 1 mg + tamoxifen placebo a kombinace tamoxifen 20 mg + anastrozol 1 mg. Primárním cílem bylo vyhodnotit bezpečnost a účinnost tamoxifenu oproti anastrozolu a kombinaci anastrozolu a tamoxifenu po dobu pěti let. Celkem 9,366 pacienty-3,125 v anastrozol ruku, 3,116 v tamoxifen ruku, a 3,125 v kombinaci ruku-byli léčeni pro medián 33 měsíců.
Po třech letech, anastrozolem prokázaly, DFS o 89,4% oproti 87.4% pro tamoxifen (poměr rizik 0.83, 95% CI , P =.013). Anastrozol se snížila míra kontralaterální prsu (CLBC) ve srovnání s tamoxifenem (poměr šancí 0.42, 95% CI , P =.007). Kombinované rameno bylo uzavřeno, protože nebyl zjištěn žádný klinický přínos nad rámec tamoxifenu. Anastrozol byl spojen s nežádoucími účinky, jako je rakovina endometria (P =.02), vaginální krvácení, výtok (p <.0001), cerebrovaskulární příhody (P =.0006), žilní tromboembolické příhody (P =.0006) A návaly horka (P <.0001); tamoxifen byl spojován s menším počtem zlomenin a menší bolestí kloubů (p <.0001). Po 68 měsících anastrozol zvýšil DFS (HR 0, 87, 95% CI, P =.01) a čas do recidivy (HR 0,79, 95% CI, P =.0005) A snížení vzdálených metastáz (HR 0,86, 95% CI, P =.04) a CLBC (42% pokles, P =.01).16 Po sledování s mediánem intervalu 100 měsíců, HR+ pacientů anastrozolem prokázaly zlepšení v DFS (HR 0.85, P =.003), výskyt CLBC (HR 0,60, P =.004), čas do opakování (HR 0,76, P =.0001) a čas do vzdálené recidivy (HR 0,84, P =.022) ve srovnání s pacienty užívajícími tamoxifen. Absolutní rozdíl v míře recidivy se zlepšil od 2.8% po pěti letech až 4,8% po devíti letech. Míra zlomenin anastrozolu byla během léčby vyšší, ale rozdíl se podstatně snížil po 100měsíčním období sledování. V období prodloužené léčby bylo riziko zlomeniny 1, 15 u anastrozolu oproti 1, 02 u tamoxifenu. Riziko karcinomu endometria byla snížena zapnutí a vypnutí terapie anastrozol ve srovnání s tamoxifenem, s roční sazbou 0,043 versus 0,14 a 0.014 versus 0.12, resp. Rozdíl v celkovém přežití (OS) nebyl zjištěn.
MA.1712,17: MA.17 byla randomizovaná, placebem kontrolovaná, dvojitě zaslepená studie hodnotící účinnost pět let letrozol terapie u postmenopauzálních žen s rakovinou prsu, kteří již dokončena o pět let adjuvantní tamoxifen terapie. Pacienti dostávali letrozol 2,5 mg nebo placebo denně po dobu pěti let. Primárním cílovým parametrem byl DFS; sekundárními cílovými parametry byla kvalita života, rozšířený bezpečnostní profil a OS. Z 5 187 pacientů dostávalo 2 593 letrozol a 2 594 placebo; medián sledování byl 2, 4 roku.
V předběžné analýzy bylo 207 lokální nebo metastatické recidivy rakoviny prsu nebo počáteční malignity CLBC, 75 v letrozol skupiny a 132 v placebové skupině. Předpokládané čtyřleté sazby DFS pro obě skupiny byly 93%, respektive 87% (P ?.001 pro vyhodnocení DFS). V rameni s letrozolem měl DFS HR 0, 61 (95% CI, P ? .001). Letrozol prokázal 43% pokles incidence rakoviny prsu (HR 0, 57, 95% CI, P =.00008).4 s výjimkou pacientů pozitivních na uzliny (P =.04), OS nedosáhl statistické významnosti (HR 0,82, P =.30).U 4 pacientů v rameni s letrozolem se vyskytly vazomotorické příznaky nízkého stupně, myalgie a artritida. Osteoporóza byla častější (i když ne významně) v rameni s letrozolem oproti placebu (5, 8% vs. 4, 5%; P =.07) a míra zlomenin byla srovnatelná mezi pažemi. Studie byla uzavřena po mediánu 2, 4 Roku z důvodu poklesu příhod rakoviny prsu v rameni s letrozolem. Rozšířená adjuvantní léčba letrozolem po dokončení pěti let tamoxifenu zlepšila DFS.
VELKÝ 1-987,9,18: Breast International Group (BIG) 1-98 studie, dvojitě slepé, multicentrické, randomizované studie, zapsal 8,028 postmenopauzálních žen s HR+ rakovinou prsu v raném stádiu. Studie se skládal ze čtyř léčebných ramen, která hodnotila pět let tamoxifen monoterapii, pět let letrozolem v monoterapii tamoxifenem po dobu dvou let a pak přechod na letrozol na dobu tří let, nebo letrozol po dobu dvou let pak přepnout na tamoxifen po dobu tří let. Primárním cílem bylo DFS; sekundárními cíli byl čas na vzdálené metastázy, bezpečnost a OS. DFS zvýšené u pacientů, kteří dostávali letrozol ve srovnání s těmi, kteří užívali tamoxifen (HR 0.81, 95% CI , relativní snížení o 19%, P =.003), s absolutním rozdílem 1,5% po třech letech. Tamoxifen zvýšený výskyt tromboembolických příhod ve srovnání s letrozol (NEBO 0,38, P <.0001). Zlomeniny kostí byly zvýšeny v rameni s letrozolem (nebo 1, 44, P =.006).
IES14, 19: IES (Intergroup Exemestan Studie) byla randomizovaná, dvojitě slepá, multicentrická, studie Fáze III, jejímž cílem bylo zjistit, zda se mění na exemestan po dvou až třech letech užívání tamoxifenu bylo účinnější než pokračování tamoxifen po dobu pěti let. Soud zapsal 4,742 postmenopauzálních žen randomizováno do dvou léčebných ramen; 2,362 předměty byly plánované přejít na exemestan 25 mg p. o. denně po dva až tři roky tamoxifen 20 mg p. o. denně k dokončení pět let léčby, a zbývající 2,380 byly naplánovány do přijmout tamoxifen 20 mg p. o. denně po dobu pěti let. Primárním cílovým parametrem byl DFS; sekundárními cílovými parametry byly OS, rozšířený profil toxicity a frekvence CLBC.
Nežádoucí účinky, které se vyskytly během mediánu 30,6 měsíců, včetně frekvence CLBC, lokální nebo metastatické recidivy, a smrt. Bylo zaznamenáno 449 příhod-183 v rameni s exemestanem a 266 v rameni s tamoxifenem. Na exemestan ruku měl neupravené HR 0,68 (95% CI , P <.001 log-rank testem), který prokázal 32% snížení rizika a byl analogický s výhodou v DFS 4.75 (95% CI) po třech letech. Po třech letech mělo rameno exemestanu DFS 91,5% (95% CI ) ve srovnání s 86,8% (95% CI) v rameni s tamoxifenem. Mezi oběma skupinami nebyl žádný významný rozdíl v OS, s 93 úmrtími v rameni s exemestanem a 106 úmrtími v rameni s tamoxifenem. Byl významný rozdíl ve frekvenci CLBC (P =.04) – 20 subjektů v rameni tamoxifenu a devět v rameni exemestanu. Použití exemestanu k dokončení pětileté léčby po dvou až třech letech tamoxifenu zlepšilo DFS ve srovnání s pěti lety tamoxifenu.
prevence úbytku kostní hmoty z terapie AI 20
postmenopauzální ženy jsou náchylné k rozvoji snížené BMD kvůli sníženým hladinám estrogenu. Terapie AI u pacientů s postmenopauzálním karcinomem prsu tuto tendenci zhoršuje. Denosumab, plně lidská monoklonální vyšetřovací protilátka, váže aktivátor receptoru pro jaderný faktor kB ligand (RANKL) a zabraňuje aktivitě RANKL. RANKL je životně důležitý pro osteoklastickou aktivitu, což znamená rozpad kosti. Denosumab a risedronát, bisfosfonát, jsou hodnoceny z hlediska jejich schopnosti působit proti úbytku kostní hmoty spojenému s terapií AI.
Denosumab Study20: multicentrické, randomizované studie Fáze III hodnotila použití denosumab 60 mg subkutánně jednou za šest měsíců u postmenopauzálních žen užívajících AIs pro HR+ nonmetastatic rakoviny prsu. Cílem bylo posoudit změnu BMD bederní páteře z výchozího stavu na 12 měsíců. Z 252 pacientů bylo 127 přiděleno denosumabu a 125 bylo zařazeno do placeba. Obě ramena dostávala vápník a vitamín D. BMD byla hodnocena pomocí duální energetické rentgenové absorpciometrie. Po 12 a 24 měsících léčby denosumabem nebo placebem byl rozdíl 5,5% a 7,6% ve zvýšení BMD v oblasti bederní páteře ve prospěch denosumabu (p <.0001 za oba měsíce). Denosumab vykazoval srovnatelný profil toxicity ve srovnání s placebem. Léčba denosumabem po dobu delší než 24 měsíců nebyla dosud hodnocena.
IBIS-II Bone Sub-Study21: Mezinárodní Prsu Intervenční Studie-II (IBIS-II) Kostní Sub-Studii byl odvozen od IBIS-II, která hodnotila postmenopauzálních žen se zvýšeným pravděpodobnost vzniku rakoviny prsu, kteří byli randomizováni do skupiny anastrozol nebo placebo po dobu pěti let. Podstudie se současným zařazením 700 pacientů hodnotí risedronát versus placebo pro prevenci ztráty BMD u žen s nízkým T-skóre na začátku. Podskupina pacientů ze studie IBIS-II byla zařazena do jedné ze tří různých léčebných strategií v dílčí studii. Po jednom roce léčby dostalo 350 pacientů s anastrozolem a 350 pacientů s placebem z IBIS-II výsledky substudie. Stratum 1 zahrnovalo 227 pacientů léčených anastrozolem s normálním T-skóre (T-skóre ?1), stratum 2 tvořilo 80 pacientů s osteopenií (ñ2.5 ? T-skóre <1), kteří byli přiděleni k risedronát 35 mg jednou týdně nebo placebo, a stratum 3 skládá 43 pacientů s osteoporózou (ñ4 <T-skóre <2.5), kteří byli přiděleni k risedronát 35 mg jednou týdně.
u pacientů s osteopenií nebo osteoporózou na začátku léčby se zdálo, že risedronát inhibuje úbytek kostní hmoty spojený s anastrozolem. Ve stratum II prokázal risedronát příznivé účinky na zachování BMD pro celkový kyčelní kloub, ale ne bederní páteř (P =.005 a P =.15, resp. placebo). S risedronátem nebyly spojeny žádné závažné nežádoucí účinky ani lékové interakce.
studie AIs u premenopauzálních žen (SOFT)21-26
přibližně 33% žen mladších 50 let bude diagnostikováno invazivní rakovina prsu. 22 suprese ovariálních funkcí (SOFT, IBCSG 24-02, BIG 2-02)zkoumá použití terapie AI u premenopauzálních žen s HR + rakovina prsu. Soud, který má cílené pacienta zápis 3000, zahrnuje premenopauzálních žen s HR+ rakovinou prsu, kteří absolvovali chemoterapii, nebo kteří obdrželi operaci. Ovariální ablace je stanovena podáváním triptorelinu (hormonu uvolňujícího gonadotropin) jednou měsíčně po dobu pěti let, chirurgickou ooforektomií nebo ozařováním pánve. Pacienti budou randomizováni do jedné ze tří zbraní, s první ruky užívajících tamoxifen jednou denně po dobu pěti let, druhé rameno užívajících tamoxifen po dobu pěti let v kombinaci s ovariální ablace, a třetí ruku užívajících exemestan po dobu pěti let v kombinaci s ovariální ablace. Pacienti dostanou exemestan nebo tamoxifen po dobu pěti let.
chemoprevence Trials23-27
Tamoxifen je indikován k chemoprevenci karcinomu prsu.6 jeho toxický profil je příčinou omezení, pokud jde o terapeutické použití.6 AIs může snížit výskyt HR+ rakoviny prsu u vysoce rizikových pacientů kvůli snížení incidence CLBC ve srovnání s tamoxifenem v klinických studiích jako ATAK.6
AI chemoprevention studie zahrnují Mezinárodní Prsu Studijní Skupiny (IBCSG) zkušební 31-03 (IBCSG 31-03) a National Cancer Institute of Canada v MAPĚ.Soud 3. Primárním cílem multicentrické, mezinárodní, randomizované, placebem kontrolované studie IBCSG 31-03 je vyhodnotit použití anastrozolu k prevenci rakoviny prsu u postmenopauzálních žen. Jeho primárním měřítkem výsledku je výskyt invazivního a neinvazivního karcinomu prsu; sekundárním měřítkem výsledku je výskyt osteoporózy a zlomenin.5 studie IBCSG 31-03 má cílový zápis 6,000. mapa.3 studie hodnotí exemestan jako chemopreventivní látku u postmenopauzálních žen. Primárním cílem placebem kontrolované mapy.3 studie má posoudit účinnost exemestanu při snižování výskytu invazivního karcinomu prsu.
Potenciální Budoucí Použití: kazuistiky
Letrozol byl používán po selhání clomiphene vyvolat plodnost u 22 žen s syndromem polycystických ovarií. Letrozol indukoval ovulaci v 75% cyklů oproti 44,4% cyklů indukovaných klomifenem. Čtyři těhotenství byla výsledkem ovulací vyvolaných letrozolem a s letrozolem nebyly spojeny žádné významné nežádoucí účinky.28,29
57-letá obézní žena s endometriózy po hysterektomii a bilaterální salpingo-ooforektomie dostávali anastrozol po megestrol terapie. Pacient neměl po devíti měsících žádné endometriální léze.28,30
pacienta s McCune-Albright syndrom byl podáván anastrozol za předčasné puberty; pacient je estradiol normalizované po 2,5 letech anastrozol a kostní věk rozšířené o šest měsíců.28,31 zvýšený estrogen může vyvolat gynekomastii a hypogonadotropní hypogonadismus.28,31 snížení estrogenu s AI vedlo k normálnímu gonadotropinu a testosteronu u mužů s gynekomastií a hypogonadotropním hypogonadismem. 28,31,32
Letrozol nebyl studován u pacientů s relapsem rakoviny vaječníků; ty, u pacientů, kteří dostávali letrozol měl stabilizace onemocnění.28,33 neoadjuvantní letrozol byl podán 10 postmenopauzálním ženám s rakovinou endometria; lék prokázal konstruktivní klinické změny a neměl žádný negativní chirurgický dopad.28,34
Při zacházení s testolactone oproti anastrozolu byla porovnávána u neplodných mužů, účinnost dva agenti byl podobný.28,35 pacientů s Klinefelterovým syndromem mělo účinnější léčbu testolaktonem než anastrozolem.28,35
Závěry
třetí generace AIs prokázaly vynikající DFS u postmenopauzálních žen s HR+ karcinomu prsu, ale klinický přínos více než pět let AI terapie u těchto pacientů nebyla stanovena.4 studie National Surgical adjuvans Breast and střevní Projekt (NSABP) B-33 (exemestane) a následná randomizace MA.17 (letrozol) studie bude zkoumat použití těchto AIs versus placebo po dobu dalších pěti let.4 AI jsou vhodnou alternativou pro HR + postmenopauzální ženy, u kterých je tamoxifen kontraindikován.4
blahodárné účinky třetí generace AIs obsahovat více přijatelný profil toxicity a lepší DFS ve srovnání s tamoxifenem. Úroveň účinnosti mezi těmito látkami a tamoxifenem je srovnatelná. Nejistota zůstává ohledně zvolené doby trvání léčby, profilu dlouhodobé toxicity a vhodného sledu podávání pro AIs.4 nové studie jsou potřebné k výrobě selektivních modulátorů aromatázy, které budou produkovat menší toxicitu než AIs.25,36-37
1. Robertson JFR. Fulvestrant (FaslodexÆ) – jak udělat dobrý lék lépe. Onkolog . 2007;12:774-784.
2. Osborne CK. Farmakoterapie: tamoxifen v léčbě rakoviny prsu. N Engl J Med. 1998;339:1609-1618.
3. Národní Komplexní Síť Pro Rakovinu. Pokyny pro klinickou praxi NCCN v onkologii-v. 1.2008. Prso. www.nccn.org/professionals/physician_gls/f_guidelines.asp, přístup k 11. říjnu 2007.
4. Winer EP, Hudis C, Burstein HJ, et al. American Society of Clinical Oncology posuzování technologií na využití inhibitorů aromatázy jako adjuvantní terapie u žen po menopauze s hormonálně pozitivním karcinomem prsu: zpráva o stavu z roku 2004. J Clin Oncol . 2005;23:619-629.
5. Dunn BK, Wickerham DL, Ford LG. Prevence rakoviny související s hormony: rakovina prsu. J Clin Oncol. 2005;23:357-367.
6. Smith IE, Dowsett m. inhibitory aromatázy u rakoviny prsu. N Engl J Med. 2003;348:2431-2442.
7. Goss PE, Strasser k. Inhibitory aromatázy při léčbě a prevenci rakoviny prsu. J Clin Oncol . 2001;19:881-894.
8. Lacy CF, Armstrong LL, Goldman MP, et al, eds. Příručka Pro Informace O Drogách. 13.vydání. Hudson, OH:Lexi-Comp; 2005: 117,598,871.
9. Ellis MJ, ed. Inhibitory aromatázy pro léčbu rakoviny prsu. Manhasset, NY: Oncology Publishing Group, CMP Healthcare Media; 2005: 29-45.
10. Arimidex (anastrozol) příbalová informace. Wilmington, DE: AstraZeneca Pharmaceuticals LP; květen 2007.
11. Arora A, Potter JF. Aromatase inhibitors: current indications and future prospects for treatment of postmenopausal breast cancer. J Am Geriatr Soc. 2004;52:611-616.
12. Femara (letrozole) package insert. East Hanover, NJ: Novartis Pharmaceuticals Corp; December 2006.
13. Shaw G. In preventing breast cancer occurrence…anastrozole beats tamoxifen in ATAC. Clin Oncol News . 1/2008. www.clinicaloncology.com/index.asp?zsv=ogst§ion_id=148&show=dept&article_id=9884. Přístup K 17. Březnu 2008.
14. Příbalová informace Aromasin (exemestan). New York, New York: Pfizer Inc; Únor 2007.
15. Baum M, Budzar AU, Cuzick J, et al, pro skupinu Trialistů ATAC. Anastrozol samotný nebo v kombinaci s tamoxifenem versus tamoxifen samotný k adjuvantní léčbě postmenopauzálních žen s časným karcinomem prsu: první výsledky randomizované studie ATAC. Lanceta. 2002;359:2131-2139.
16. Howell a, Cuzick J, Baum M, et al, pro skupinu Trialistů ATAC. Výsledky studie ATAC (Arimidex, Tamoxifen, samotný nebo v kombinaci) po ukončení 5leté adjuvantní léčby rakoviny prsu. Lanceta. 2005;365:60-62.
17. Goss PE, Ingle JN, Martino S, et al. Randomizovaná studie letrozolu u postmenopauzálních žen po pěti letech léčby tamoxifenem pro časné stadium rakoviny prsu. N Engl J Med. 2003;349:1793-1802.
18. Thrlimann B, Keshaviah A, Coates AS, et al, pro skupinu Breast International Group (BIG) 1-98 Collaborative Group. Srovnání letrozolu a tamoxifenu u postmenopauzálních žen s časným karcinomem prsu. N Engl J Med. 2005;353:2747-2757.
19. Coombes RC, Hall E, Gibson LJ, et al, pro studii Intergroup Exemestane. Randomizovaná studie exemestanu po dvou až třech letech léčby tamoxifenem u postmenopauzálních žen s primárním karcinomem prsu. N Engl J Med. 2004; 350:
1081-1092.
20. Ellis G, Bone HG, Chlebowski R, et al. Studie fáze 3 o účinku léčby denosumabem na kostní minerální hustotu u žen užívajících inhibitory aromatázy pro nemetastatický karcinom prsu. Příspěvek prezentován na: 30. výroční San Antonio Breast Cancer Symposium; prosinec 13-16, 2007; San Antonio, TX. Abstrakt 47.
21. Singh S, Cuzick J, Edwards R, et al. Vliv anastrozolu na kostní minerální hustotu po jednom roce léčby: výsledky dílčí studie kostní studie Mezinárodní intervenční studie rakoviny prsu (IBIS-II). Příspěvek prezentovaný na: 30. ročník San Antonio Breast Cancer Symposium; prosinec 13-16, 2007; San Antonio, TX. Abstrakt 28.
22. Dellapasqua S, Colleoni M, Gelber RD, Goldhirsch A. Adjuvantní endokrinní terapie u premenopauzálních žen s časným karcinomem prsu. J Clin Oncol. 2005;23:1736-1750.
23. Národní Onkologický Ústav. Léčba rakoviny prsu (PDQ). www.cancer.gov/cancertopics/pdq/treatment/breast/healthprofessional, přístup k 26. prosinci 2007.
24. Klinické studie Baylor College of Medicine. Potlačení ovariální funkce Trial (SOFT). www.breastcenter.tmc.edu/clinic/trials/soft.htm, přístup k 26. prosinci 2007.
25. Aebi S, Castiglione-Gertsch m. adjuvantní endokrinní terapie pro velmi mladé pacienty. Prsa. 2003;12:509-515.
26. ClinicalTrials.gov. Potlačení funkce vaječníků plus buď tamoxifen, nebo exemestan v porovnání s tamoxifenem sám v léčbě premenopauzálních žen s hormonálně citlivé rakoviny prsu. www.clinicaltrials.gov/. přístup k 26. prosinci 2007.
27. Cuzick J. Inhibitory aromatázy pro prevenci rakoviny prsu. J Clin Oncol. 2005;23:1636-1643.
28. Karaer O, OruÁ S, Koyuncu FM. Inhibitory aromatázy: možné budoucí aplikace. Acta Obstet Gynecol Scand. 2004:83:699-706.
29. Mitwally MF, Casper RF. Použití inhibitoru aromatázy k indukci ovulace u pacientů s nedostatečnou odpovědí na klomifen citrát. Fertil Steril. 2001;75:305-309.
30. Bulun SE, Yang S, Fang Z, et al. Role aromatázy při endometriálním onemocnění. J Steroid Biochem Mol Biol. 2001;79:19-25.
31. Feuillan P, Merke D, Leschek EW, Cutler GB. Použití inhibitorů aromatázy v předčasné pubertě. Rakovina Endokr Relat. 1999;6:303-306.
32. Shozu M, Sebastian S, Takayama K, et al. Přebytek estrogenu spojený s novými mutacemi zesílení funkce ovlivňujícími Gen aromatázy. N Engl J Med. 2003;348:1855-1865.
33. Bowman A, Gabra H, Langdon SP, et al. Odpověď CA 125 je spojena s expresí estrogenového receptoru ve studii fáze II s letrozolem u rakoviny vaječníků: identifikace endokrinně citlivé podskupiny. Clinton Res. 2002; 8: 2233-2239.
34. Berstein L, Maximov S, Gershfeld E, et al. Neoadjuvantní léčba rakoviny endometria inhibitorem aromatázy letrozolem: endokrinní a klinické účinky. Eur J Obstet Gynecol Reprod Biol. 2002;105:161-165.
35. Raman JD, Schlegel PN. Inhibitory aromatázy pro mužskou neplodnost. J Urola. 2002;167:624-629.
36. Simpson ER, Dowsett m. aromatáza a její inhibitory: význam pro léčbu rakoviny prsu. Nedávné Prog Horm Res. 2002; 57: 317-338.