dobrým výchozím bodem, kdy musíte najít elektronovou konfiguraci iontu, je elektronová konfigurace neutrálního atomu.
ve vašem případě musíte najít elektronovou konfiguraci fluoridového aniontu, # “ F „^ ( – )#, takže začněte psaním elektronové konfigurace neutrálního atomu fluoru, # „F“#.
fluor se nachází v periodě 2, skupině 17 periodické tabulky a má atomové číslo #9#. To vám říká, že neutrální atom fluoru má celkem# 9 # elektronů obklopujících jeho jádro.
a Jeho elektronová konfigurace bude
#“F:“ 1s^2 2s^2 2p^5#
Nyní, #“F“^(-)# anion je tvořen, když #1# elektron je přidán do neutrální atom fluoru.
Všimněte si, že 2p-subshell neutrálního atomu obsahuje # 5 # elektrony. Jeho maximální kapacita je ve skutečnosti# 6 # elektrony, dva elektrony pro každý P-orbital.
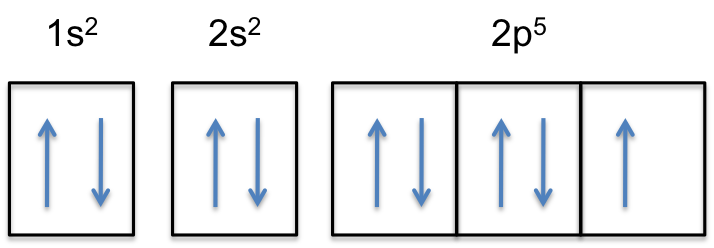
to znamená, že # barva (červená) („extra elektron“)# bude přidána k jednomu ze tří 2p-orbitalů, řekněme #2p_y#.
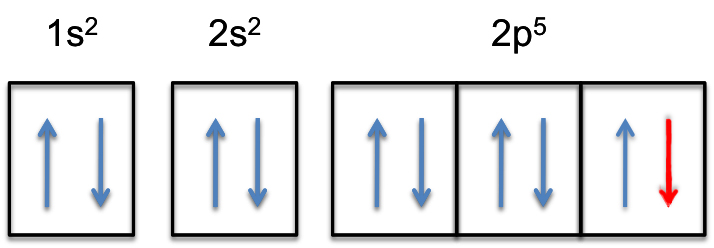
2P-subshell bude nyní zcela naplněn, tj.
elektronové konfigurace fluorid anion tedy bude
#barva(zelená)(|bar(ul(barva(bílá)(a/a), barva(černá)(„F“^(-):barva(bílá)(a) 1s^2color(bílá)(a) 2s^2 barvy(bílá)(a)2p^6)barva(bílá)(a/a)|)))#
Všimněte si, že fluorid anion má celkem #8# elektrony ve druhém obalu, valenční vrstvě. To vám říká, že anion má kompletní oktet.
Protože fluoridových aniontů je isoelectronic s neon, #“Ne“#, můžete psát své elektronovou konfiguraci pomocí vzácného plynu zkrácený zápis
#“F“^(-): #
## – elektronovou konfiguraci neonu,