jaký je redoxní potenciál buňky?
čtecí režim
redoxní potenciály se používají k charakterizaci nákladů na volnou energii a směru reakcí zahrnujících přenos elektronů, jedné z nejrozšířenějších a nejdůležitějších biochemických reakcí. Taková redukce-oxidační reakce jsou charakterizovány volná energie změna, která sdílí některé koncepční prvky, který se používá k popisu pKa v acidobazické reakce, kde přenosu protonu se podílí spíše než přenos elektronů. V této vinětě, jedné z nejvíce abstraktních v knize, diskutujeme o tom, jak lze redoxní potenciál použít jako měřítko hnací síly pro danou oxidačně-redukční reakci. Naproti tomu, na rozdíl od pH, neexistuje žádný smysl, ve kterém by člověk mohl přiřadit jediný redoxní potenciál celé buňce.
redoxní potenciál nebo přesněji redukční potenciál sloučeniny se týká její tendence získávat elektrony a tím být redukován. Někteří čtenáři si možná pamatují mnemotechnickou „OILRIG“, která nám připomíná, že „oxidace je ztráta, redukce je zisk“, kde ztráta a zisk jsou elektrony. Zvažte reakce, která zahrnuje přenos elektronů: Aox + ne– ↔ Ku, kde n elektrony jsou převzata oxidované formě (Aox) dát redukovanou formu (Ku) sloučeniny. Redox potenciál rozdíl ΔE mezi elektron donor a akceptor se vztahuje k souborům změna volné energie ΔG reakce prostřednictvím ΔG=nFΔE, kde n je počet elektronů převedených a F je Faradayova konstanta (96,485 J/mol/V nebo ≈100 kJ/mol/V). Kontrolou tabulkových hodnot těchto potenciálů je možné vyvinout intuici pro tendenci k přenosu elektronů a tím i směru reakce.

Obrázek 1: „redoxní věže“ ukazovat redox potenciál společné metabolické půl reakcí. Metabolické procesy lze považovat za pohybující se elektrony mezi molekulami, často zachycující část energie uvolněné při pohybu elektronů z vysoké energie do nižších energetických stavů, jako je glykolýza nebo dýchání. Elektrony darované“ polovičními reakcemi “ nahoře mohou být spotřebovány v poloviční reakci nižší na věži, aby se dokončila termodynamicky příznivá reakce. Například čistý proces glykolýzy zahrnuje oxidaci glukózy na pyruvát spojený s redukcí NAD + na NADH. Protože oxidace glukózy leží v horní části věže a redukce NAD+ je pod ní, je tento tok elektronů termodynamicky příznivý. Ve srovnání s barem stupnice hydrolýzy ATP můžeme také vidět, že tento tok elektronů je dostatečně příznivý pro generování ATP. Aerobní dýchání zahrnuje mnoho mezilehlých elektronových přenosů elektronovým transportním řetězcem. Je ukázáno několik těchto přechodů, včetně oxidačního sukcinátu na fumarát, který je mechanicky spojen s redukcí ubichinonu na ubichinol ve vnitřních mitochrondriálních membránách. Každý z těchto přechodných elektronových přenosů musí být sám o sobě termodynamicky příznivý, aby mohlo pokračovat dýchání. Porovnáním „hydrolýzy ATP rozsahu“ můžeme vidět, že jednotlivé transformace v elektrontransportním řetězci nejsou aktivní natolik, aby generovat ATP na vlastní pěst. Přesto jsou dostatečně příznivé, aby pumpovaly proton přes buňku nebo mitochondriální membránu. Toto je energetický základ pro chemiosmózu: buňky ukládají kvanta energie příliš malé pro syntézu ATP v protonovém gradientu přes membránu. Tato energie se později používá k výrobě ATP přeměnou gradientu H + na fosfoanhydridové vazby na ATP prostřednictvím ATP syntázy.
ačkoli se často tvrdí, že ATP je energetickou měnou buňky, ve skutečnosti jsou pro energetickou rovnováhu buňky nosiče redukční síly samy o sobě neméně důležité. Nejdůležitějším příkladem těchto nosičů je molekula NADH ve svých redukovaných nebo oxidovaných (NAD+) formách. Můžeme použít redoxní potenciál pro spojení těchto dvou molekulárních protagonistů a odhadnout horní hranici počtu molekul ATP, které mohou být vyrobeny oxidací NADH(vyrobené například v cyklu TCA). NAD+/NADH dvojice má redoxní potenciál E = -0.32 V a to je oxidován kyslíkem za vzniku vody (protony přicházející z médií) s redox potenciálu E = +0.82 V. Jak jsou uvedeny na Obrázku 1 jako součást „redox věž“ klíčových biologický poločas reakce, které mohou být spojeny najít celkovou redox potenciál změnit a tedy volné energie. Pro reakce za výše NADH oxidací kyslíkem, maximální souborům volné energie, které lze získat, je tedy
ΔG = n x F x ΔE = 2 x 100 kJ/(molxV) x (0.82-(-0.32)) V = 230 kJ/mol≈ 90 kBT,
, kde n=2 a F≈100kJ/mol/V. Jako hydrolýza ATP má volná energie změna ≈50kJ/mol za fyziologických podmínek zjistíme, že 228 kJ/mol stačí vyrábět maximálně 228/50≈4.5 Atp. V buňce probíhá oxidace NADH několika kroky v dýchání a vede k přenosu 10 protonů přes membránu proti elektrochemickému potenciálu (BNID 101773). Tyto protonové přenosy odpovídají dalšímu způsobu zachycení biochemické energie. Tato energie je pak použita Atpázou k výrobě 2-3 ATP. Zjistili jsme tedy, že asi polovina energie, která byla uvolněna při přenosu elektronů z NADH na kyslík, je zachována v ATP. Zajistit, že reakce probíhá ve směrové způsobem k výrobě ATP, spíše než konzumovat to vyžaduje, že některé energie je „zbytečný“, protože systém musí být z rovnováhy.
proč bychom měli diskutovat o redoxních potenciálech polovičních reakcí a ne volných energiích plných reakcí? Jednotky sami vděčí za svůj původ na schopnosti v oblasti elektrochemie pro měření v laboratoři, rozdíl napětí, tj. potenciál měřený ve voltech, po dvou komor, které obsahují různé přenašeče elektronů, a zastavit net reakce s napětím. Užitečnost redoxních potenciálů pro poločas reakce spočívá ve schopnosti sestavit kombinace různých dárců a akceptory k posouzení termodynamické proveditelnosti a energetický zisk z každé za reakce. Pokud máte k možné sloučeniny přenosu elektronů, možné reakce ~k2 lze předvídat pouze na základě redoxních potenciálů k.
stejně jako jsme mluvit o pH roztoku, v první odhad, můžeme si představit, že by bylo možné hovořit o zřejmě obdobné jako redox potenciál buňky. Znát koncentrace redukované a oxidované formy dané reakce dvojice definuje jejich bazénu redox potenciálu pomocí vztahu
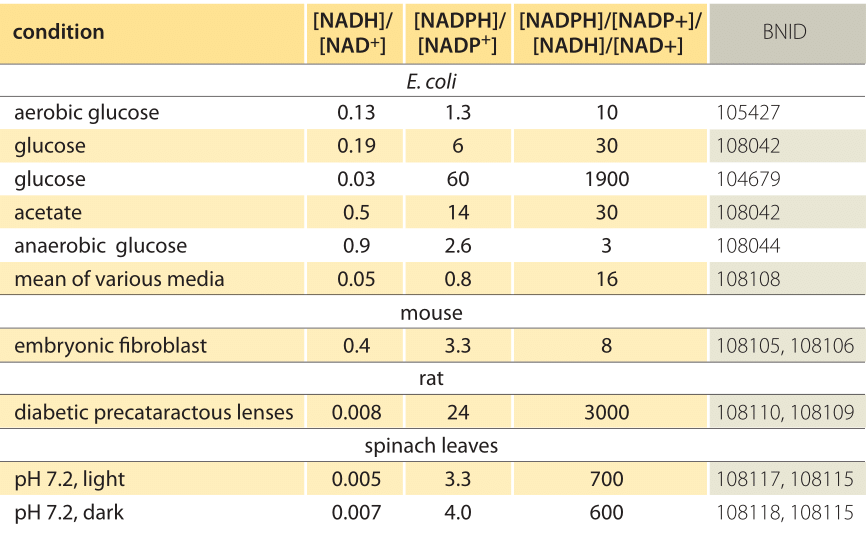
Tabulka 1: koncentrace poměry společný elektronový dárce páry NAD/NADH a NADP/NADPH. Jak je vidět, první je relativně oxidován a druhý relativně redukován s poměrem mezi nimi obvykle mnohem větším než 1.nernstova rovnice) poskytuje hodnotu redoxního potenciálu za koncentračních podmínek typických pro buňku na rozdíl od standardních stavových podmínek (kde podle definice =). Jako příklad zvažte darování elektronu NAD+, což vede k oxidované formě NADH. V mitochondriální matrici je uveden poměr 10krát více oxidované formy (BNID 100779), jak je znázorněno v tabulce 1. V tomto případě zjistíme, že faktor je ≈30 mV a tím se redoxní potenciál mění z -0,32 v na -0,29 v. Ujistěte se, že směr efekt, co máme, je rozumné všimli jsme si, že s nadbytkem oxidované formě tendenci být oxidovány kyslíkem je poněkud nižší, jak je vidět na skutečnosti, že redoxní potenciál je nyní blíže než dříve, že kyslíku/voda elektronové výměně pár (+0.82 V).
buňka není v rovnováze a existuje slabá vazba mezi různými redoxními páry. Tato situace vede k vytvoření různých redoxních potenciálů pro koexistující redoxní páry v buňce. Pokud tavidla výroby a využití redukované a oxidované formy oxidačně-redukčního páru, Ku a Aox a další Chováni a Pole jsou mnohem větší, než jejich interconversion tok, Ku+Box<>Aox+Bred pak a a B může mít velmi různé redoxní potenciály. V důsledku toho je špatně definováno ptát se na celkový redoxní potenciál buňky, protože se bude lišit pro různé složky v buňce. Naopak pH v buňce (nebo v prostoru) je mnohem lepší definovanými protože voda slouží jako univerzální médium, které páry různé acidobazické reakce a vyrovná to, co je známý jako chemický potenciál všech druhů.
pro daný redoxní pár v daném buněčném kompartmentu koncentrační poměr obou forem předepisuje redoxní potenciál dobře definovaným způsobem. Sloučeniny, které rychle vyměňují elektrony, budou v relativní rovnováze, a tak sdílejí podobný redoxní potenciál. Vidět, jak tyto myšlenky hrát ven, tak to je většinou užitečné, aby zvážila, redoxní pár, který se podílí v mnoha klíčových buněčných reakcí, a, jako výsledek, je pevně spojené s redox stav mnoha sloučenin. Glutathion v cytoplazmě je takové sloučeniny, jako se podílí na redukci a oxidaci vysoce převládající thiol dluhopisy (ty, které obsahují síru) v cystein, aminokyseliny, mnoho bílkovin. Glutathion je tripeptid (složený ze 3 aminokyselin), ústřední jeden cystein, který může být v redukované (GSH) nebo oxidované formě, kde vytváří dimer s cystein z jiné molekuly glutathionu (označuje GSSG). Půl reakce pro glutathion je tedy 2 x GSH <> GSSG + 2e– + 2H+. Druhá polovina reakcí je často síry pouto, které je „otevřel“ v receptivní bílkovin tedy držena v redukované formě vzhledem k neustálým působením glutathionu. Glutathion je také dominantním hráčem v neutralizaci reaktivních sloučenin, které mají vysokou tendenci chytat elektrony a oxidovat tak další molekuly. Takové sloučeniny se vyrábějí za oxidačního stresu, jako například při dosažení kapacity reakcí přenosu elektronů při dýchání nebo fotosyntéze. Souhrnně nazývané ROS (reaktivní kyslíkové druhy) mohou v buňce způsobit zmatek a jsou zapojeny do mnoha procesů stárnutí. Dvojí role glutathionu v souladu proteiny složené a omezení ROS, stejně jako jeho relativně vysoká koncentrace a přenos elektronů reaktivita, aby to hlavním ukazatelem redox stavu buňky. Koncentrace glutathionu v buňce je ≈10 mm (BNID 104679, 104704, 111464), což je druhý nejhojnější metabolit v buňce (po glutamát) zajistí, že hraje dominantní roli jako donoru elektronů v redoxní regulaci funkce proteinu. V dalších funkcích buněk existují další dominantní elektronové páry. V biosyntetických anabolických reakcích je pár NADP+/NADPH a při poruchových katabolických reakcích je NAD+/NADH.
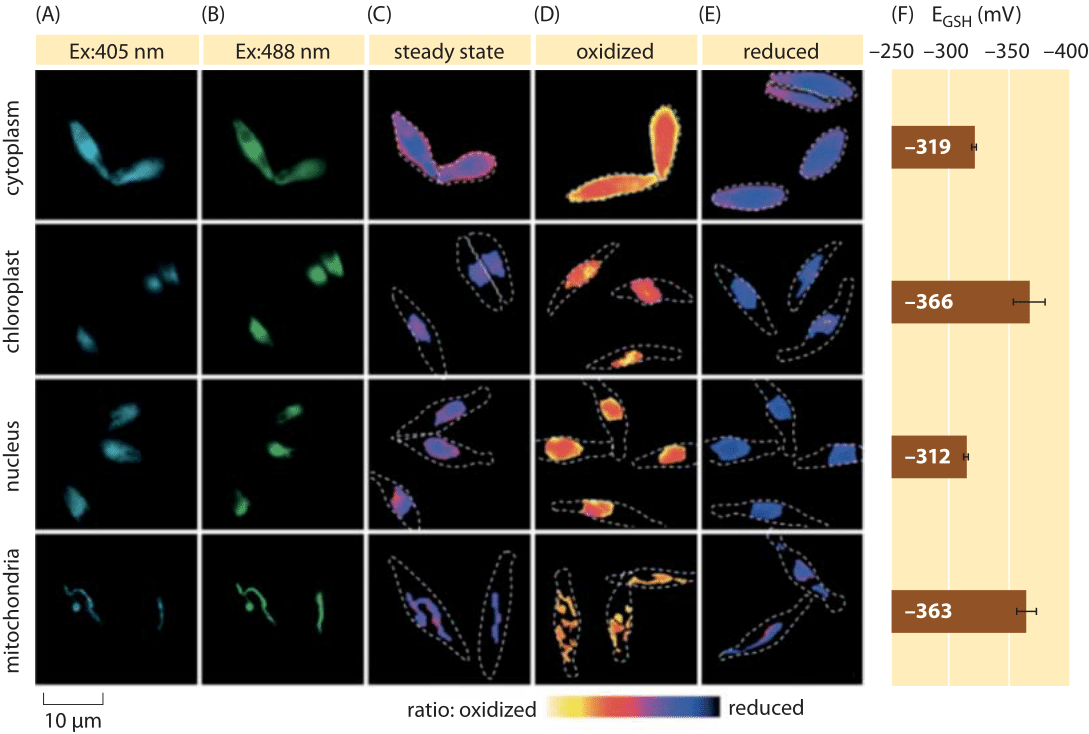
Obrázek 2: zobrazení buněčné redox potenciál glutathion bazén v rozsivky řasy in vivo. Fluorescenční mikroskopie zobrazování buněk p. tricornutum exprimujících roGFP2 v různých subcelulárních lokalizacích. Fluorescenční obrazy na dvou excitačních vlnových délkách (A, B) byly rozděleny, aby se získaly ratiometrické hodnoty (C). Pro kalibraci jsou ratiometrické snímky zachyceny za podmínek silného oxidačního činidla (150 mM H2O2) (D) a redukčního činidla (1 mM DTT) (E). Přerušované čáry představují obrys buněk, nakreslený na základě obrázků jasného pole. (F) v Ustáleném stavu redox potenciál glutathion bazén, EGSH v mV, byla vypočtena na základě Nernstova rovnice pomocí oxidace úrovni v rámci dané hodnoty pH pro jednotlivé organely. Převzato z: S. Graff van Creveld et al., ISME J., 9: 385, 2015.
Jak jde o měření redoxních potenciálů v živých buňkách? Dalším příjemcem fluorescenční proteinové revoluce byl předmět redoxních potenciálů. Reportér GFP byl navržen tak, aby být redoxně citlivé začlenění cystein aminokyselin, které mají vliv fluorescence na základě jejich snížení glutathionu bazén. Obrázek 2 ukazuje výsledek použití takového reportéra k pohledu na redoxní potenciál glutathionu v různých kompartmentech rozsivek.
Z měření redoxní stav glutathionu bazénu v různých buněčných organel a za různých podmínek můžeme odvodit poměr koncentrace snížena na oxidované formy. Hodnoty se pohybují od asi -170 mV v ER a v apoptotických buněk na cca -300 mV ve většině ostatních organel a v proliferaci buněk (BNID 103543, 101823, 111456, 111465). Vzhledem k tomu, že standardní redoxní potenciál glutathionu je -240 mV (BNID 111453, 111463), jaký je pak poměr redukovaného k oxidovanému glutathionu? Pomocí Nernstova rovnice (nebo ekvivalentně, z Boltzmannova rozdělení), deset-krát změnit v produktu/reaktantu poměr odpovídá zvýšení ≈6 kJ/mol ve volné energie (≈2 kBT). Vzhledem k 2 elektrony převedeny v GSH/GSSG reakcí tento koncentrační poměr změna je obvykle rovná 30mV, i když pro glutathion, stechiometrie 2 GSH molekuly sloučení do jednoho GSSG kovalentně vázaná molekula dělá to jen aproximace. 100 mV změnu hlásil, přes podmínky odráží poměr koncentrace mezi přibližně stejné množství redukované a oxidované formy (v apoptotických buněk) až přes 1000 krát více koncentrace redukované formě. Ve většině buněčných podmínek je oxidovaná forma jen velmi malým zlomkem celkového fondu, ale stále s fyziologickými důsledky.
jedním z nejasných aspektů redoxních reakcí je, že přenos může mít několik podob. V jednom případě se jedná pouze o elektrony jako v reakcích prováděných cytochromy v řetězcích přenosu elektronů. V jiném běžném případě se jedná o kombinaci elektronů a protonů jako v kofaktoru NAD+ / NADH, kde jsou přeneseny dva elektrony a jeden proton (H+). Nakonec existují reakce, kdy se přenáší stejný počet elektronů a protonů, když by člověk přirozeně byl v pokušení diskutovat o přenosu vodíků. To je například případ celkové reakce oxidace glukózy, kdy je kyslík redukován na vodu. Byly tedy přeneseny dva vodíky, takže by se mělo diskutovat o přenosu elektronů, vodíků nebo protonů? Definice redoxního potenciálu (uvedená výše) se zaměřuje pouze na elektronový „stav“. Co o protony a co se stane, když jeden narazí na řetězec přenosu elektronů reakce, kde některé meziprodukty obsahují vodíkové protony a některé ne? Vysvětlení spočívá v okolní vodě a jejich pH. Reakce probíhá při daném pH, a reagující sloučeniny jsou v rovnováze s pH a tím vydávat nebo přijímat proton, nemá žádný vliv na energetiku. Vodné médium slouží jako bazén, kde protonů může být „zaparkovaná“ při převodu reakce je pouze elektronů (analogie vypůjčené z velmi přístupné úvodní biochemie knize „chemie života“ Steven Rose). Tyto zaparkované protony si lze půjčit zpět v následných fázích, jak se vyskytuje v konečné fázi oxidační dýchání, kde cytochrom oxidáza trvá protonů ze střední. Protože člověk předpokládá, že voda je všudypřítomná, nemusí se počítat s protony, s výjimkou znalosti převládajícího pH, které zobrazuje tendenci dávat nebo přijímat protony. This is the reason why we discuss electron donors and acceptors rather than hydrogen donors and acceptors.




