zvažte delokalizaci elektronové hustoty. To je, když je hustota elektronů rozložena co nejvíce po celé molekule, takže minimální nahromadění náboje je přítomno v daném orbitalu.
který je popsán:
- souhrnně všemi přispěvateli rezonance v Lewisových strukturách.
- souhrnně všemi jednotlivými molekulárními orbitálními příspěvky v molekulárních orbitálních diagramech.
(existují jemné rozdíly mezi nimi, ale ty jsou zhruba analogické pro jednoduchost. Více podrobností naleznete zde.)
lokalizace elektronové hustoty je nedostatek.
To je, když jsme se nacpat všechny elektronové hustoty do několika orbitaly, místo toho, aby šíření, a to téměř nikdy nestane v reálném molekuly nebo kvantový systém (i když tam je žádné rezonance děje).
PŘÍKLAD S REZONANČNÍ STRUKTURY.
Zvážit izolované (ne-reakce) allyl kation, #“C“_3″H“_5^(+)#.
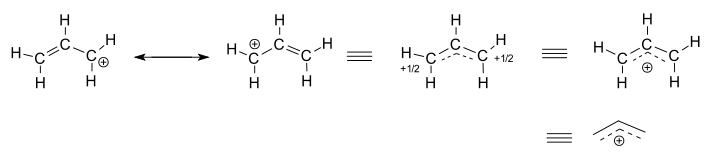
- dvě struktury jsou rezonance přispěvatelů, z nichž každý je lokalizován reprezentace pravda delokalizována struktury.
- tři pravostranné struktury jsou reprezentací rezonanční hybridní struktury nebo delokalizované struktury.
delokalizovaná struktura je v podstatě popsána sbírkou vazebných molekulárních orbitalů.
PŘÍKLAD S MOLEKULÁRNÍ ORBITÁLNÍ DIAGRAM
Zvážit allyl kation opět v MO diagram, který popisuje POUZE #bbpi# elektrony (tj. elektrony, které by v #pi# dluhopisů v lokalizované dvojnou vazbu!), ale umožňuje účast na reakce:
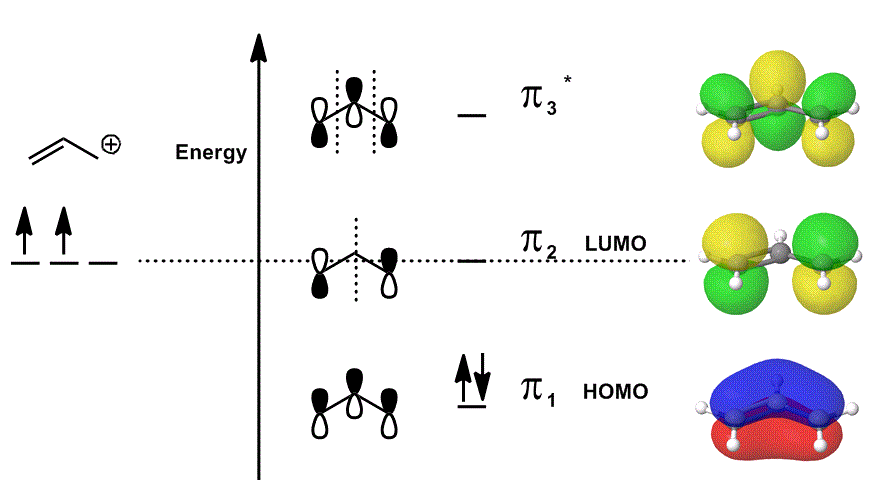
- Každý z orbitální příspěvky uprostřed jsou znázorněny lokalizované; atomové orbitaly, které by přesahovaly, jsou zobrazeny jako oni sami (fáze ceně).
- každý z orbitalů na pravé straně (jeden na řádek) jsou zobrazeny delokalizované; hustota elektronů se může šířit tak, že molekulární orbitaly jsou zobrazeny s úplným zvážením přesahů, uzlů a fází.
Když se překrývají #pi_1#, #pi_2#, a #pi_3^“*“# a začlenit vážené příspěvek těchto států (váženou podle koeficientů #c_i#), dostanete lineární kombinace molekulové orbitaly:
#Psi_(„allyl“^(+)) = c_1overbrace(pi_1)^“lepení“ + c_2overbrace(pi_2)^“nonbonding“ + c_3overbrace(pi_3^“*“)^“antibonding“#
a #Psi_(„allyl“^(+))# pak popisuje celkové rozdělení států, které společně popisují reaktivita allyl kation.
jinými slovy, #pi_1# (který daruje #pi# elektrony bond), #pi_2# (který přijímá elektrony dluhopisů), a #pi_3^“*“# (v tomto případě, je to jen zřídka se účastní) všechny něco udělat, když allyl-kation se účastní chemické reakce, protože (pokud je obsazeno), existují současně.