Mechanismy Enzymatické Katalýzy
vazba substrátu na aktivní místo enzymu je velmi specifické interakce. Aktivní stránky jsou rozštěpy nebo drážky na povrchu enzymu, obvykle se skládá z aminokyselin, z různých částí polypeptidového řetězce, které jsou sdruženy v terciární struktuře složené bílkoviny. Substráty se zpočátku vážou na aktivní místo nekovalentními interakcemi, včetně vodíkových vazeb, iontových vazeb a hydrofobních interakcí. Jakmile je substrát navázán na aktivní místo enzymu, může několik mechanismů urychlit jeho přeměnu na produkt reakce.
ačkoli jednoduchý příklad popsaný v předchozí části zahrnoval pouze jednu molekulu substrátu, většina biochemických reakcí zahrnuje interakce mezi dvěma nebo více různými substráty. Například tvorba peptidové vazby zahrnuje spojení dvou aminokyselin. Pro takové reakce vazba dvou nebo více substrátů na aktivní místo ve správné poloze a orientaci urychluje reakci (obrázek 2.23). Enzym poskytuje šablonu, na které reaktanty jsou dohromady a správně orientovaná na prospěch tvorbě přechodového stavu, ve kterém budou komunikovat.

obrázek 2.23
enzymatická katalýza reakce mezi dvěma substráty. Enzym poskytuje šablonu, na které jsou oba substráty spojeny ve správné poloze a orientaci, aby spolu reagovaly.
enzymy urychlují reakce také změnou konformace jejich substrátů tak, aby se přiblížily stavu přechodu. Nejjednodušším modelem interakce enzym-substrát je model lock-and-key, ve kterém substrát přesně zapadá do aktivního místa (obrázek 2.24). V mnoha případech jsou však konfigurace enzymu i substrátu modifikovány vazbou na substrát-procesem zvaným indukované přizpůsobení. V takových případech je konformace substrátu změněna tak, že se více podobá konformaci přechodového stavu. Napětí vyvolané takovým zkreslením substrátu může dále usnadnit jeho přeměnu na přechodový stav oslabením kritických vazeb. Přechodový stav je navíc stabilizován jeho těsnou vazbou na enzym, čímž se snižuje požadovaná energie aktivace.

obrázek 2.24
modely interakce enzym-substrát. A) v modelu lock-and-key substrát přesně zapadá do aktivního místa enzymu. (B) v modelu indukovaného přizpůsobení vazba substrátu narušuje konformace substrátu i enzymu. Toto zkreslení (více…)
kromě toho přináší více substrátů spolu a narušení konformace substráty pro přístup přechodový stav, mnoho enzymů, které se podílejí přímo v katalytického procesu. V takových případech mohou specifické aminokyselinové postranní řetězce v aktivním místě reagovat se substrátem a vytvářet vazby s reakčními meziprodukty. Kyselé a bazické aminokyseliny jsou často zapojeny do těchto katalytických mechanismů, jak je znázorněno v následující diskusi o chymotrypsinu jako příkladu enzymatické katalýzy.
Chymotrypsin je členem rodiny enzymy (serinové proteázy), které digest proteinů katalyzující hydrolýzu peptidových vazeb. Reakce může být zapsána následovně:

různí členové rodiny serinových proteáz (včetně chymotrypsinu, trypsinu, elastázy a trombinu) mají odlišná specifika substrátu; přednostně štěpí peptidové vazby sousedící s různými aminokyselinami. Například, zatímco chymotrypsin tráví vazby sousedící s hydrofobními aminokyselinami, jako je tryptofan a fenylalanin, trypsin tráví vazby vedle základních aminokyselin, jako je lysin a arginin. Všechny serinové proteázy mají však podobnou strukturu a používají stejný mechanismus katalýzy. Aktivní místa těchto enzymů obsahují tři kritické aminokyseliny-serin, histidin a aspartát-které řídí hydrolýzu peptidové vazby. Tyto enzymy se skutečně nazývají serinové proteázy kvůli centrální úloze serinového zbytku.
substráty se vážou na serinové proteázy vložením aminokyseliny sousedící s místem štěpení do kapsy v aktivním místě enzymu (obrázek 2.25). Povaha této kapsy určuje substrátovou specificitu různých členů rodiny serinových proteáz. Například vazebná kapsa chymotrypsinu obsahuje hydrofobní aminokyseliny, které interagují s hydrofobními postranními řetězci jeho preferovaných substrátů. V kontrastu, vazba kapsy trypsin obsahuje záporně nabité kyselých aminokyselin (aspartát), který je schopen tvořit iontové vazby s lysin nebo arginin zbytky z jeho substrátů.
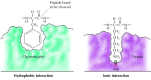
obrázek 2.25
vazba substrátu serinovými proteázami. Aminokyseliny sousedí s peptidové vazby být štěpen, je vložena do kapsy v aktivním místě enzymu. V chymotrypsinu se kapsa váže na hydrofobní aminokyseliny; vazebná kapsa trypsinu obsahuje (více…)
vazba substrátu umístí peptidovou vazbu, která má být štěpena, vedle serinu aktivního místa (obrázek 2.26). Proton tohoto serinu se pak přenese do aktivního místa histidinu. Konformace aktivního místa podporuje tento přenos protonů, protože histidin interaguje se záporně nabitým zbytkem aspartátu. Serin reaguje se substrátem a vytváří čtyřstěnný přechodový stav. Peptidová vazba se pak štěpí a C-koncová část substrátu se uvolní z enzymu. N-terminální peptid však zůstává vázán na serin. Tato situace je vyřešena, když molekula vody (druhý substrát) vstoupí do aktivního místa a obrátí předchozí reakce. Proton molekuly vody se přenese na histidin a jeho hydroxylová skupina se přenese do peptidu, čímž se vytvoří druhý tetrahedrální přechodový stav. Proton se pak přenese z histidinu zpět na serin a peptid se uvolní z enzymu a dokončí reakci.

obrázek 2.26
katalytický mechanismus chymotrypsinu. Tři aminokyseliny v aktivním místě (Ser-195, His-57 a Asp-102) hrají rozhodující roli v katalýze.
Tento příklad ilustruje několik funkcí enzymatická katalýza, specifita enzymu, substrátu interakcí, polohování různé molekuly substrátu v aktivním místě, a zapojení aktivních reziduí v místě při tvorbě a stabilizaci přechodového stavu. Ačkoli tisíce enzymů v buňkách katalyzují mnoho různých typů chemických reakcí, pro jejich činnost platí stejné základní principy.