Kateřina Gara
leden 2016—Hlenu nemusí být něco, co my jako na to myslet, ale na tom závisely naše životy. U cystické fibrózy (CF) vede zahušťování hlenu mimo jiné k plicním infekcím a střevním blokům. Onemocnění je způsobeno jediným genem postiženým jednou nebo více z více než 1700 mutací, o nichž je známo, že poruchu způsobují. Na Johns Hopkins, výzkumné pracovníky a lékaře genetici pracují společně, aby se naučit všechno, co mohou o genu, jeho bílkovin a co se děje u pacientů, s vědomím, že každý kus informace, které garner je přivést je blíže k mít možnosti léčby pro všechny osoby s CF.
Podej Mi Sůl
v Těchto dnech, u pacientů s CF jsou mnohem lepší, díky ošetření, které spravují jejich časté plicní infekce, ale diagnóza CF stále znamená, že průměrná délka života pouhých 38 vzhledem k mýtné to trvá na slinivky břišní, jater a střev. Problém pochází z defektů v genu transmembránového regulátoru vodivosti cystické fibrózy (CFTR), který nese plán proteinu CFTR. Protein CFTR je jako poštovní slot v předních dveřích. Tvoří malý průchod mezi vnitřkem a vnějškem buňky.
při správné práci pomáhá CFTR řídit průchod chloridových iontů (složky soli) dovnitř a ven z buňky. V plicích a kanálech pankreatu, když chlorid opouští buňky, povzbuzuje vodu, aby následovala. Tato voda pomáhá vytvářet tenké vrstvy hlenu. V plicích hlen zachycuje prach a bakterie, které by tam neměly být. Řasinky, nebo hairlike struktur, na buňky, které lemují plíce a pak pastýř hlenu do dýchacích cest do úst, kde se dostane při požití a poslal k trávení. V pankreatu tekutina pomáhá přenášet enzymy do střeva, aby pomohla při trávení potravin. V případě, že hlen je příliš viskózní, v plicích, řasinky nemůže pohybovat, takže bakterie zůstávají tam způsobit infekce, pokud je příliš viskózní v pankreatických kanálků, enzymy nedosahují střeva, a jídlo není stravitelné správně.
Protein je Cesta,
Garry Řezání, profesor v Ústavu Genetické Medicíny, a Bill Guggino, ředitel Odboru Fyziologie, studovali CFTR genu a jeho kódovaný protein pro většinu jejich kariéry. Cutting zájem pramení z péče o dvojici bratrů s CF, zatímco rezident v Johns Hopkins. Gugginův zájem sahá ještě dál-k jeho chlapeckým výletům k moři. Přemýšlel, jak mohou ryby přežít ve slané vodě, a zjistil, že krátká odpověď zní: jejich verze CFTR.
Pokud se zdá obtížné, aby si představit, se zaměřením na celou kariéru na jeden gen a jeho proteinový produkt, myslím, že to místo jako komplexní rubikovy kostky vyrobené z řetězu 1,480 magnetické kameny (aminokyseliny). Mutace v genu CFTR bude často znamenat změnu jedné z aminokyselin, která může dramaticky ovlivnit konečnou trojrozměrnou formu.
některé mutace způsobují, že protein není vyroben. Jiné umožňují syntézu částečného proteinu. Čím blíže k začátku proteinu dochází k těmto mutacím, tím horší je jeho funkce. Jiné mutace se vyskytují právě na nesprávném místě a zabraňují například otevření solného kanálu. Ještě jiní dělají CFTR fold nesprávně, což signalizuje týmu kontroly kvality buňky, aby ji vyzvedl a recykloval. A jiní neinterferují s funkcí proteinu, ale brání tomu, aby se dostal do plazmatické membrány, kde vykonává svou práci.
Cutting a gugginovo úsilí přispěly k návrhu dvou CF léků na trhu: ivacaftor a lumacaftor. Ivakaftor aktivuje CFTR nesoucí mutaci G551D. Řezání laboratoři první uvádí, že tato mutace v roce 1990, a Guggino a Řezání následně generovány román pohledy na vliv této mutace na CFTR funkce a symptomy pacientů. Bohužel mutace G551D se vyskytuje pouze u 4 procent pacientů s CF. Ukazuje se však, že 50 procent pacientů s CF má dvě kopie jiné mutace (nazývané delta F508), což způsobuje, že CFTR je špatně tvořen a odeslán do recyklačního koše buňky. Lumakaftor zabraňuje recyklaci, takže se dostane do plazmatické membrány. Pak, ivacaftor mu dává „kop“, který potřebuje k práci.
„delta F508 CFTR je stále postižený, ale je to lepší než nic,“ říká Guggino. „A to znamená, že už neléčíme jen příznaky. Léčíme základní příčiny.“
Žádné Dítě nezůstane Pozadu
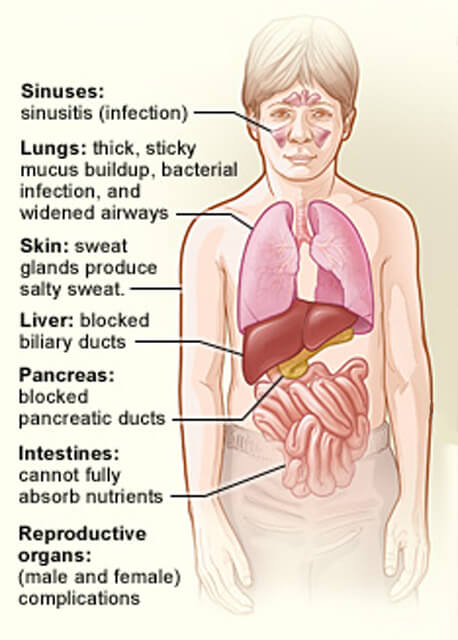 orgány postiženy cystickou fibrózou.
orgány postiženy cystickou fibrózou.Credit: National Heart, Lung and Blood Institute
Více než 40 procent pacientů s CF s jinými mutacemi – některé poměrně vzácné-nejsou vždy tak šťastné. Existuje více než 1700 mutací v genu CFTR, které způsobují CF, a pouze malá část byla testována na odpověď na schválené léky. Někteří z testovaných reagují na jeden nebo druhý lék, ale jiní ne. přesto vědci doufají, že jednou budou schopni pomoci všem. Řezání předpokládá, že nakonec kategorizuje každého pacienta podle typu, slovo, které vytvořil, aby popsal skupiny pacientů, kteří pravděpodobně reagují na stejnou terapii kvůli společné základní příčině jejich příznaků. Je úzce spolupracuje s kolegy Patricka Sosnay a Karen Raraigh dolovat data z 88,000 lidí po celém světě k testování jeho pojetí.
můžeme použít informace generované experimenty v buňky skupina mutací, které ovlivňují stejné vlastnosti CFTR, a proto by měl reagovat na stejný panel CFTR drogy. Seskupování mutací podle typu by umožnilo klinické studie na pacientech nesoucích různé mutace, namísto klinických studií, které vyhodnocují jednu mutaci najednou, “ říká Cutting. „To je přesná medicína stává realitou.“
bohužel terapie založené na lécích nebudou fungovat u všech pacientů s CF, zejména u 2 procent, kteří vůbec nevytvářejí CFTR. Pro tyto, vědci vyvíjejí způsoby, jak zacílit na samotný mutovaný gen, i když stále existuje mnoho překážek, které je třeba překonat.
Guggino vyvinul systém genové terapie, který používá modifikovaný adeno-asociovaný virus (AAV) k uložení Dobré verze genu CFTR uvnitř buněk. Systém se osvědčil v lidských buňkách dýchacích cest a hlodavcích.
se Snaží o jiný přístup, Liudmila Cebotaru, z Katedry Medicíny, vymysleli nový způsob, jak spojit genové terapie a bílkovin opravy mechanismem s názvem transcomplementation. Místo umístění genu CFTR v plné délce do AAV používá kratší verzi, která se snadněji vkládá do genomu buňky. Když se vytvoří kratší protein, váže se na mutantní protein pacienta a pomáhá mu dostat se do plazmatické membrány. Cebotaru i Guggino nyní testují svůj nový přístup u opic rhesus, protože jejich plíce a imunitní systém jsou velmi blízké lidem. Doufají, že v příštích několika letech zahájí klinické hodnocení, pokud vše půjde dobře.
„rád to považuji za skákání baterie vašeho auta,“ říká. „S trochou další pomoci se proteiny CFTR pacientů mohou dostat na místo určení.“
pro výzkumné pracovníky i pacienty není cíl nic menšího než lék na CF. A i když je to ještě daleko, existují povzbudivé signály, že se tam můžeme dostat.