Varmekurver
figur \(\Sideindeks{3}\) viser en varmekurve, et plot af temperatur versus opvarmningstid, for en 75 g prøve vand. Prøven er oprindeligt is ved 1 atm og -23 liter C; når der tilsættes varme, stiger isens temperatur lineært med tiden. Linjens hældning afhænger af både isens masse og den specifikke varme (Cs) af is, hvilket er antallet af joules, der kræves for at hæve temperaturen på 1 g is med 1 liter C. Når temperaturen på isen stiger, absorberer vandmolekylerne i iskrystallen mere og mere energi og vibrerer mere kraftigt. Ved smeltepunktet har de nok kinetisk energi til at overvinde attraktive kræfter og bevæge sig i forhold til hinanden. Efterhånden som der tilsættes mere varme, stiger systemets temperatur ikke yderligere, men forbliver konstant ved 0 liter C, indtil al isen er smeltet. Når al isen er omdannet til flydende vand, begynder vandets temperatur igen at stige. Nu stiger temperaturen dog langsommere end før, fordi vandets specifikke varmekapacitet er større end isens. Når vandets temperatur når 100 liter C, begynder vandet at koge. Også her forbliver temperaturen konstant ved 100 liter C, indtil alt vandet er omdannet til damp. På dette tidspunkt begynder temperaturen igen at stige, men i en hurtigere hastighed end set i de andre faser, fordi dampens varmekapacitet er mindre end is eller vand.
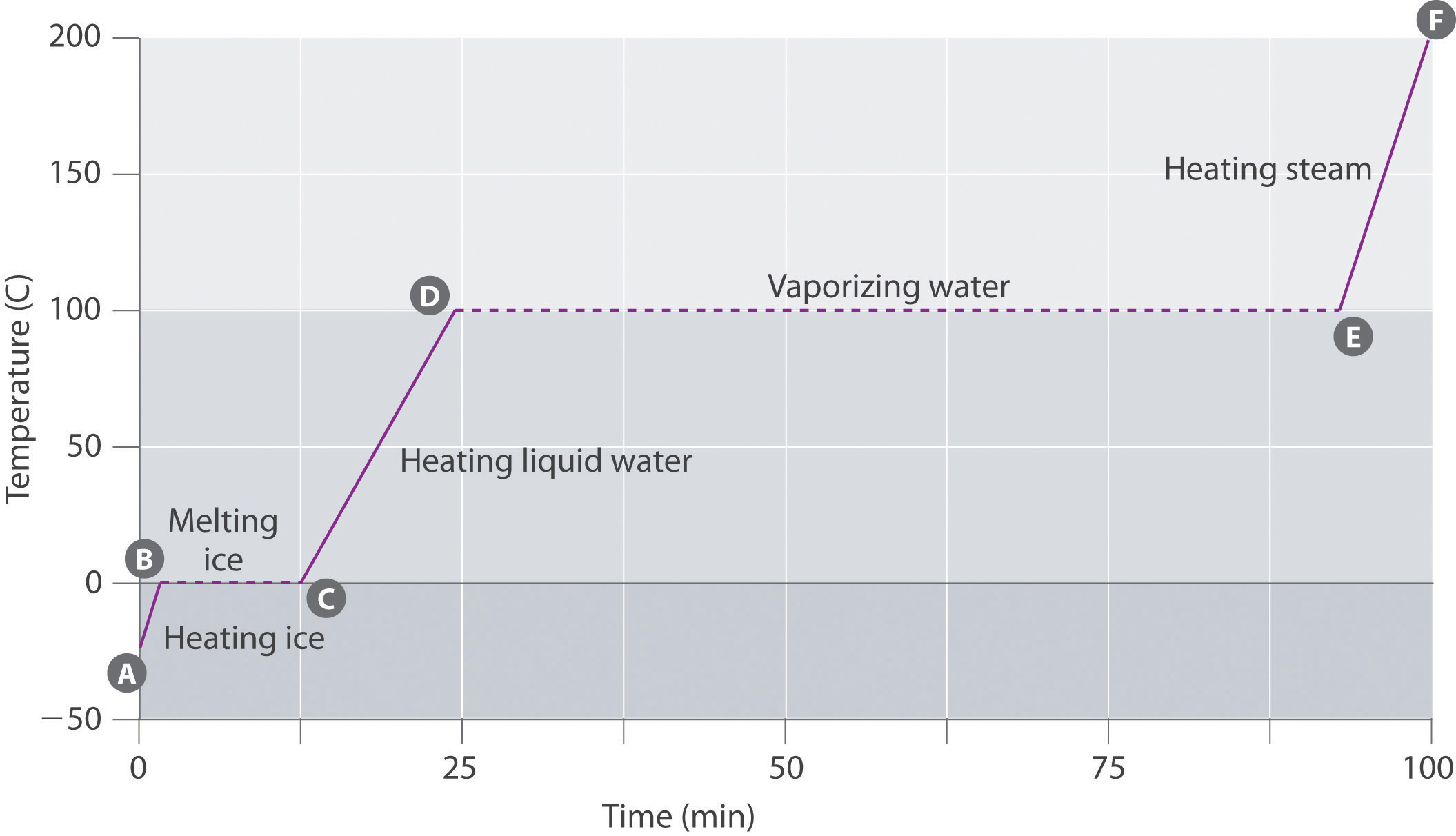
således ændres temperaturen i et system ikke under en faseændring. I dette eksempel, så længe selv en lille mængde is er til stede, forbliver systemets temperatur ved 0 liter C under smelteprocessen, og så længe selv en lille mængde flydende vand er til stede, forbliver systemets temperatur ved 100 liter C under kogeprocessen. Den hastighed, hvormed varme tilsættes, påvirker ikke temperaturen på is/vand eller vand/dampblanding, fordi den tilsatte varme udelukkende bruges til at overvinde de attraktive kræfter, der holder den mere kondenserede fase sammen. Mange kokke tror, at mad vil koge hurtigere, hvis varmen er skruet op højere, så vandet koger hurtigere. I stedet vil vandkanden koge til tørhed hurtigere, men vandets temperatur afhænger ikke af, hvor kraftigt det koger.
temperaturen af en prøve ændres ikke under en faseændring.
Hvis der tilsættes varme med en konstant hastighed, som i figur \(\Sideindeks{3}\), er længden af de vandrette linjer, der repræsenterer den tid, hvor temperaturen ikke ændres, direkte proportional med størrelsen af entalpierne, der er forbundet med faseændringerne. I figur \(\Sideindeks{3}\) er den vandrette linje ved 100 kilogram C meget længere end linjen ved 0 kilogram C, fordi entalpien for fordampning af vand er flere gange større end entalpien for fusion.
en overophedet væske er en prøve af en væske ved den temperatur og det tryk, ved hvilket det skal være en gas. Overophedede væsker er ikke stabile; væsken vil til sidst koge, nogle gange voldsomt. Fænomenet overophedning forårsager” bumping”, når en væske opvarmes i laboratoriet. Når et reagensglas indeholdende vand opvarmes over en bunsenbrænder, kan en del af væsken let blive for varm. Når den overophedede væske omdannes til en gas, kan den skubbe eller “støde” resten af væsken ud af reagensglasset. Placering af en omrøringsstang eller et lille stykke keramik (en “kogende chip”) i reagensglasset gør det muligt at danne bobler af damp på objektets overflade, så væsken koger i stedet for at blive overophedet. Overophedning er grunden til, at en væske opvarmet i en glat kop i en mikrobølgeovn muligvis ikke koger, før koppen er flyttet, når koppens bevægelse tillader dannelse af bobler.