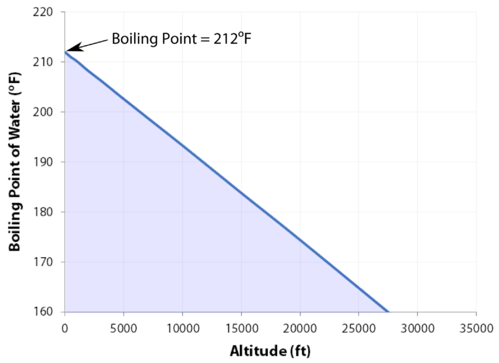
kogepunkt
når en væske opvarmes, øges den gennemsnitlige kinetiske energi af dens partikler. Fordampningshastigheden øges, da flere og flere molekyler er i stand til at undslippe væskens overflade i dampfasen. Til sidst nås et punkt, når molekylerne i hele væsken har nok kinetisk energi til at fordampe. På dette tidspunkt begynder væsken at koge. Kogepunktet er den temperatur, hvor damptrykket af en væske er lig med det ydre tryk. Figuren nedenfor illustrerer kogning af væske.
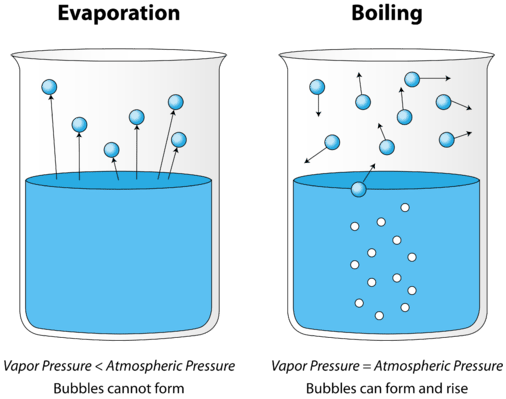
på billedet til venstre er væsken under kogepunktet, men noget af væsken fordamper. Til højre er temperaturen blevet forøget, indtil bobler begynder at danne sig i væskens krop. Når damptrykket inde i boblen er lig med det ydre atmosfæriske tryk, stiger boblerne til væskens overflade og brister. Den temperatur, ved hvilken denne proces forekommer, er væskens kogepunkt.
det normale kogepunkt er den temperatur, hvor væskens damptryk er lig med standardtryk. Da atmosfærisk tryk kan ændre sig baseret på placering, ændres kogepunktet for en væske med det ydre tryk. Det normale kogepunkt er en konstant, fordi det er defineret i forhold til standard atmosfærisk tryk på \(760 \: \tekst{mm} \: \ce{Hg}\) (eller \(1 \: \tekst{atm}\) eller \(101.3 \: \tekst{kPa}\)).