Nyoksreaktioner handler om, at elektroner overføres fra et stof til et andet, så det er nyttigt at have et system til at holde styr på, hvad der vinder og hvad der mister elektroner, og hvor mange elektroner der er involveret. Systemet til registrering af reaktioner kaldes Iltningstal. Du kan også huske noget, der hedder elektronegativitet fra tidligere kemi klasser.
elektronegativitet
et bundet atoms evne til at tiltrække delte elektroner mod sig selv.
Når to atomer af forskellige elementer er bundet sammen af en kovalent binding (deling af elektroner), deles elektronerne generelt ikke ligeligt mellem de to atomer på grund af forskelle i deres elektronegativiteter. Tænk på dette som en slæbebåd for elektroner. Nogle gange trækker begge atomer med samme styrke på delte elektroner; andre gange er der helt klart en stærkere spiller, der trækker elektronerne tættere på sig selv.
overvej bindingen mellem et hydrogenatom (med en valenselektron) og et iltatom (med dets seks valenselektroner):
|
|
+
|
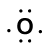 |
=
|
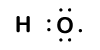 |
Because oxygen has a higher electronegativity than hydrogen, the shared electrons are closer to the oxygen atom than to brintatomet. Dette er ikke den samlede overførsel af elektroner, der ville skabe en ion, men delvise ladninger dannes. Brintenden af bindingen er delvist positiv (+1), fordi den delvist har mistet en elektron, og iltenden af H-O er delvist negativ (-1), fordi den delvist har fået den ene elektron fra brint:
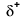 |
|
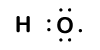 |
|
Our molecule is incomplete, however, because there is a lone electron around oxygen. Let’s add one more hydrogen to complete our water molecule:
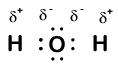
Vi ser, at hver af de to hydrogener har “mistet” en elektron til ilt. Ilt har “fået” to elektroner—en fra hvert brint. Igen er disse ikke sande ioner, men det er nyttigt at tænke på dem på samme måde.ladninger givet til atomer i et molekyle på denne måde kaldes iltningstal. Vi kan bruge iltningstal til at holde styr på, hvor elektroner er i et molekyle, og hvordan de bevæger sig under en reaktion. I vores vandeksempel tildeles brint et iltningstal på +1, fordi hvert enkelt brint har “mistet” en elektron. Ilt har et iltningstal på +2, fordi det enkelte iltatom har “fået” i alt to elektroner, en fra hvert brint.
Her er et andet molekyle, der involverer brint og ilt—brintoverilte, H2O2:
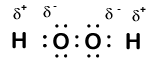
i brintoverilte har hvert brint stadig et iltningstal på +1, fordi hvert brint “giver op” en enkelt elektron til ilt. Ilt har imidlertid nu et iltningstal på -1, fordi hvert ilt kun får en elektron fra dets nærliggende brint. Elektronerne mellem de to identiske iltatomer deles ligeligt, så der er ingen delvis ladning som følge af denne binding.et positivt eller negativt tal tildelt et atom i et molekyle eller en ion, der afspejler en delvis gevinst eller tab af elektroner.
at kende iltningstallet for hvert enkelt element i et molekyle vil være et vigtigt skridt i vores forståelse af reaktionerne. Heldigvis involverer det normalt ikke tegning af elektronprik-diagrammer. I stedet er der en række regler, som vi kan bruge til at bestemme oksidationsnumre. Her er de vigtigste regler:
| iltningsnummeret for et rent element (i sig selv og ikke en ion) er nul. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
The oxidation number of a monatomic ion (by itself or as part of an ionic compound) is equal til sin ladning.alkalimetaller-elementer i den første kolonne i det periodiske system—vil altid have et iltningstal på +1; jordalkalimetaller (kolonne 2) er næsten altid +2. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The oxidation number of hydrogen is almost always +1 when it is in a compound. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
iltningstallet er næsten altid -2, når det er i en forbindelse. undtagelserne:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
+14 total
2 Mn atoms
|
= +7
|
| Compound |
Element
|
Oxidation Number |
Number of Atoms |
Total
|
| Mg3N2 |
Mg
|
+2
|
3
|
+6
|
|
N
|
-3
|
2
|
-6
|
|
|
SUM
|
0
|
|||
| Mn2O7 |
Mn
|
+7
|
2
|
+14
|
|
O
|
-2
|
7
|
-14
|
|
|
SUM
|
0
|
|||
| Cl2O3 |
Cl
|
+3
|
2
|
+6
|
|
O
|
-2
|
3
|
-6
|
|
|
SUM
|
0
|
|||
summen af iltningstallene i en polyatomisk ion er lig med ladningen på den ion.
igen skal du arbejde baglæns for at bestemme iltningsnummeret for ethvert ikke-ilt-eller ikke-hydrogenatom.
for at bestemme oksidationsnummeret af Cr i Cr2O72 -:
- ilt vil være -2 (Regel 4), for i alt:
-2 list 7 = -14
- da summen af oksidationsnumrene vil være -2 (ladningen på hele ion), skal summen for alle Cr være +12 fordi:
+12 + (-14) = -2
- da der er to Cr, vil hver Cr have et iltningstal på +6.
= +7
|
+12
2
|
= +6
|
| Compound |
Element
|
Oxidation Number |
Number of Atoms |
Total
|
| NO3- |
N
|
+5
|
1
|
+5
|
|
O
|
-2
|
3
|
-6
|
|
|
SUM
|
-1
|
|||
| Cr2O72- |
Cr
|
+6
|
2
|
+12
|
|
O
|
-2
|
7
|
-14
|
|
|
SUM
|
-2
|
|||
| SO42- |
S
|
+6
|
1
|
+6
|
|
O
|
-2
|
4
|
-8
|
|
|
SUM
|
-2
|
|||
It is det er vigtigt at bemærke, at iltningstallet altid refererer til hvert enkelt atom i forbindelsen, ikke til summen for det pågældende element.
for eksempel i H2O vil den samlede positive” ladning ” for begge hydrogenatomer være +2 (som balancerer med -2 fra ilt), men hvert hydrogen har et iltningstal på +1.
Bidrag & tilskrivninger
denne side blev konstrueret ud fra indhold via følgende bidragyder (er) og redigeret (topisk eller udførligt) af Libreteksterne udviklingsteam for at møde platformstil, præsentation og kvalitet:
-
CK-12 Foundation af Richard Parsons, Therese Forsythe, Shonna Robinson og Jean Dupon.