læringsmål
- brug cellenotation til at beskrive galvaniske celler
- Beskriv de grundlæggende komponenter i galvaniske celler\
galvaniske celler, også kendt som voltaiske celler, er elektrokemiske celler, hvor spontane iltningsreduktionsreaktioner producerer elektrisk energi. Ved at skrive ligningerne er det ofte praktisk at adskille iltningsreduktionsreaktionerne i halvreaktioner for at lette afbalancering af den samlede ligning og for at understrege de faktiske kemiske transformationer.
overvej hvad der sker, når et rent stykke kobbermetal placeres i en opløsning af sølvnitrat (figur \(\Sideindeks{1}\)). Så snart kobbermetallet er tilsat, begynder sølvmetal at danne sig, og kobberioner passerer ind i opløsningen. Den blå farve af opløsningen længst til højre indikerer tilstedeværelsen af kobberioner. Reaktionen kan opdeles i dens to halvreaktioner. Halvreaktioner adskiller iltningen fra reduktionen, så hver kan betragtes individuelt.
ligningen for reduktionshalvereaktionen måtte fordobles, så antallet af elektroner “vundet” i reduktionshalvereaktionen svarede til antallet af elektroner “tabt” i iltningshalvreaktionen.

galvaniske eller voltaiske celler involverer spontane elektrokemiske reaktioner, hvor halvreaktionerne adskilles (figur \(\Sideindeks{2}\)), så strømmen kan strømme gennem en ekstern ledning. Bægeret på venstre side af figuren kaldes en halvcelle og indeholder en 1 M opløsning af kobber(II) nitrat med et stykke kobbermetal delvist nedsænket i opløsningen. Kobbermetallet er en elektrode. Kobberet gennemgår iltning; derfor er kobberelektroden anoden. Anoden er forbundet til et voltmeter med en ledning, og den anden terminal på voltmeteret er forbundet til en sølvelektrode med en ledning. Sølvet er under reduktion; derfor er sølvelektroden katoden. Halvcellen på højre side af figuren består af sølvelektroden i en 1 M opløsning af sølvnitrat (AgNO3). På dette tidspunkt strømmer der ingen strøm—det vil sige ingen signifikant bevægelse af elektroner gennem ledningen, fordi kredsløbet er åbent. Kredsløbet lukkes ved hjælp af en saltbro, som transmitterer strømmen med bevægelige ioner. Saltbroen består af en koncentreret, ikke-reaktiv elektrolytopløsning, såsom natriumnitrat (NaNO3) opløsning anvendt i dette eksempel. Når elektroner strømmer fra venstre mod højre gennem elektroden og ledningen, passerer nitritioner (anioner) gennem det porøse stik til venstre ind i kobber(II) nitratopløsning. Dette holder bægeret til venstre elektrisk neutralt ved at neutralisere ladningen på kobber(II) ioner, der produceres i opløsningen, når kobbermetallet iltes. Samtidig bevæger nitritionerne sig til venstre, natriumioner (kationer) bevæger sig til højre gennem det porøse stik og ind i sølvnitratopløsningen til højre. Disse tilsatte kationer “erstatter” sølvionerne, der fjernes fra opløsningen, da de blev reduceret til sølvmetal, hvilket holder bægeret til højre elektrisk neutralt. Uden saltbroen ville rumene ikke forblive elektrisk neutrale, og ingen signifikant strøm ville strømme. Men hvis de to rum er i direkte kontakt, er en saltbro ikke nødvendig. I det øjeblik kredsløbet er afsluttet, læser voltmeteret + 0,46 V, Dette kaldes cellepotentialet. Cellepotentialet skabes, når de to forskellige metaller er forbundet, og er et mål for den energi pr.enhedsladning, der er tilgængelig fra iltningsreduktionsreaktionen. Volt er den afledte SI-enhed for elektrisk potentiale
\
i denne ligning er a strømmen i ampere og C ladningen i coulombs. Bemærk, at volt skal ganges med ladningen i coulombs (C) for at opnå energien i joules (J).
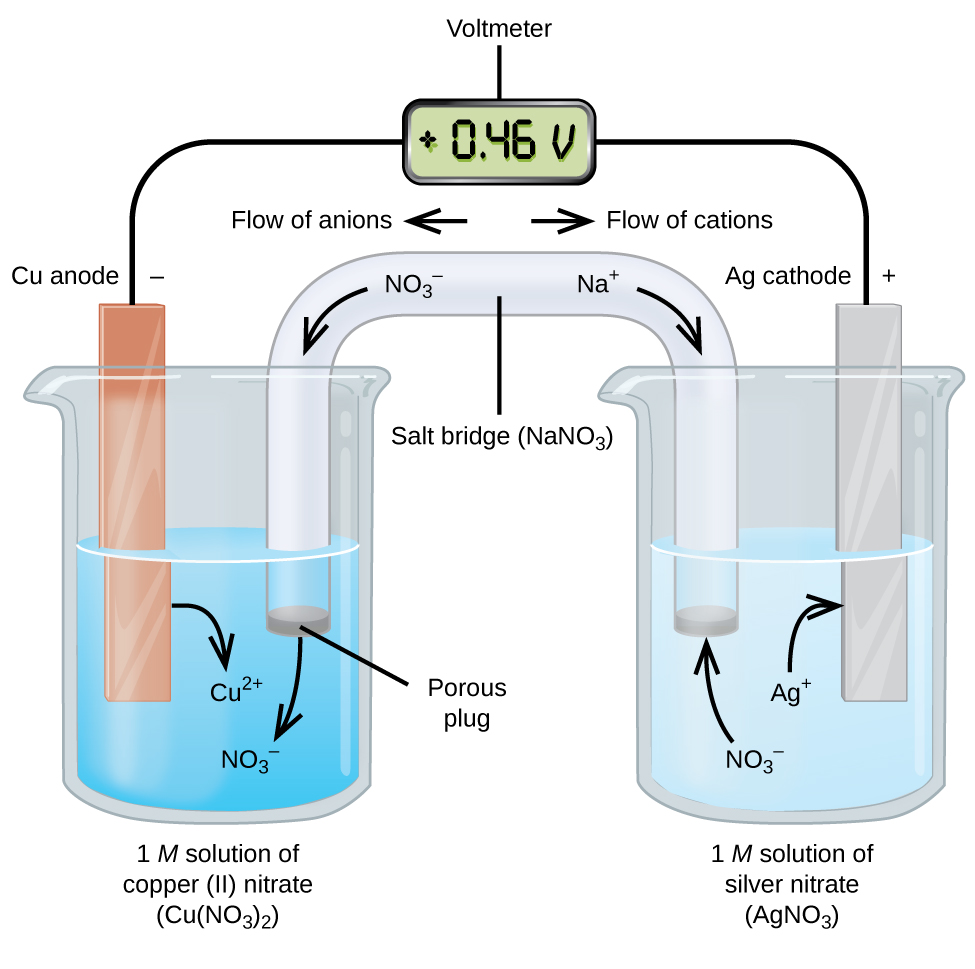
når den elektrokemiske celle er konstrueret på denne måde, indikerer et positivt cellepotentiale en spontan reaktion, og at elektronerne strømmer fra venstre til højre. Der sker meget i figur \(\Sideindeks{2}\), så det er nyttigt at opsummere ting for dette system:
- elektroner strømmer fra anoden til katoden: venstre mod højre i standard galvanisk celle i figuren.
- elektroden i den venstre halvcelle er anoden, fordi iltning forekommer her. Navnet henviser til strømmen af anioner i saltbroen mod den.
- elektroden i højre halvcelle er katoden, fordi reduktion sker her. Navnet henviser til strømmen af kationer i saltbroen mod den.
- Oksidering forekommer ved anoden (den venstre halvcelle i figuren).
- reduktion sker ved katoden (den højre halvcelle i figuren).
- cellepotentialet, +0,46 V, skyldes i dette tilfælde de iboende forskelle i arten af de materialer, der anvendes til fremstilling af de to halvceller.
- saltbroen skal være til stede for at lukke (fuldføre) kredsløbet, og både en iltning og reduktion skal forekomme for at strømmen kan strømme.
der er mange mulige galvaniske celler, så en stenografisk notation bruges normalt til at beskrive dem. Cellenotationen (undertiden kaldet et cellediagram) giver information om de forskellige arter, der er involveret i reaktionen. Denne notation fungerer også for andre typer celler. En lodret linje, kr., betegner en fasegrænse og en dobbelt linje, kr., saltbroen. Oplysninger om anoden er skrevet til venstre efterfulgt af anodeopløsningen, derefter saltbroen (når den er til stede), derefter katodeopløsningen og endelig information om katoden til højre. Cellenotationen for den galvaniske celle i figur \(\Sideindeks{2}\) er derefter
\
Bemærk, at tilskuerioner ikke er inkluderet, og at den enkleste form for hver halvreaktion blev brugt. Når det er kendt, er de indledende koncentrationer af de forskellige ioner normalt inkluderet.
en af de enkleste celler er Daniell-cellen. Det er muligt at konstruere dette batteri ved at placere en kobberelektrode i bunden af en krukke og dække metallet med en kobbersulfatopløsning. En opløsning af kobbersulfat flyder oven på kobbersulfatopløsningen; derefter anbringes en sincelektrode i sincsulfatopløsningen. Tilslutning af kobberelektroden til sinc-elektroden tillader en elektrisk strøm at strømme. Dette er et eksempel på en celle uden en saltbro, og ioner kan strømme over grænsefladen mellem de to opløsninger.
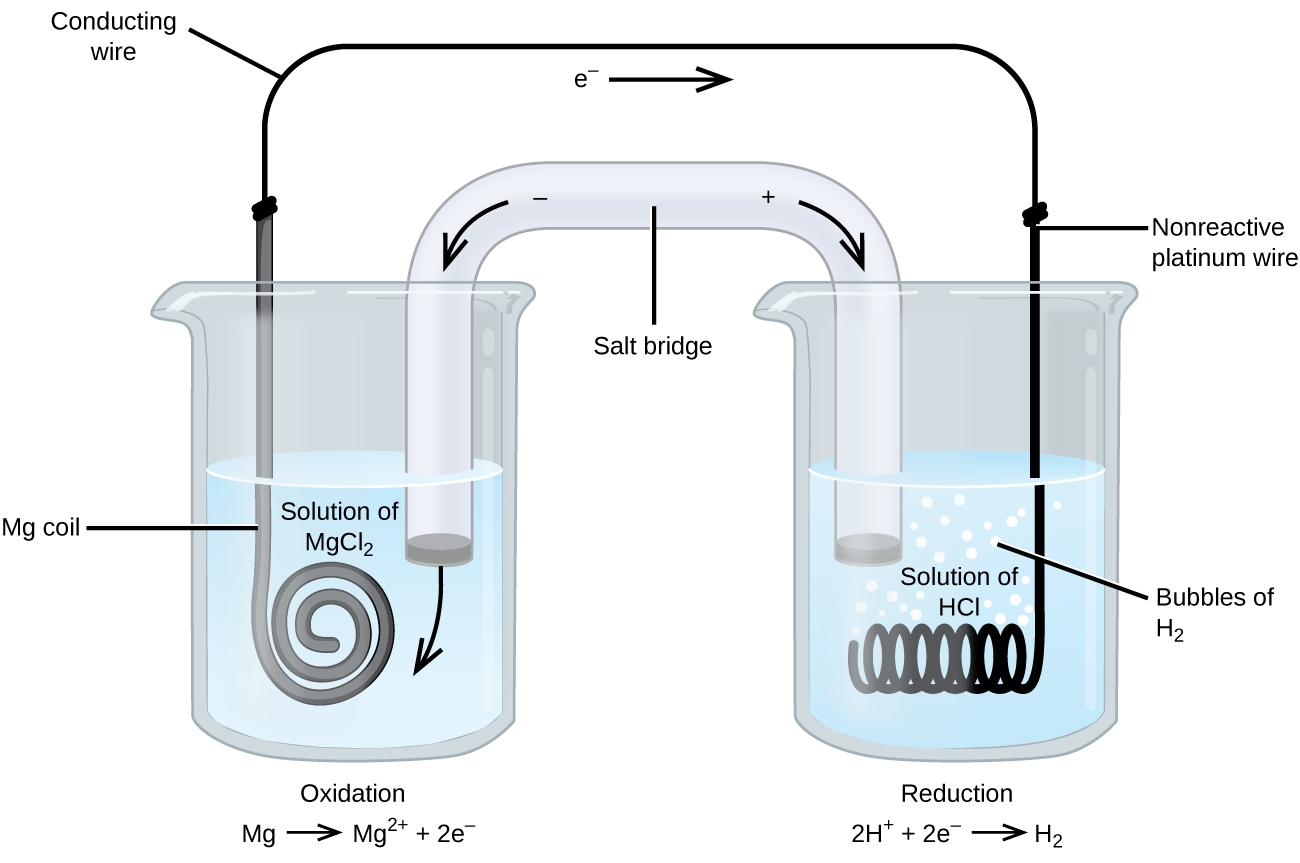
nogle iltningsreduktionsreaktioner involverer arter, der er dårlige ledere af elektricitet, og der anvendes således en elektrode, der ikke deltager i reaktionerne. Ofte er elektroden platin, guld eller grafit, som alle er inerte over for mange kemiske reaktioner. Et sådant system er vist i figur \(\Sideindeks{3}\). Magnesium gennemgår iltning ved anoden til venstre i figuren, og hydrogenioner gennemgår reduktion ved katoden til højre. Reaktionen kan opsummeres som
cellen brugte en inert platintråd til katoden, så cellenotationen er
magnesiumelektroden er en aktiv elektrode, fordi den deltager i iltningsreduktionsreaktionen. Inerte elektroder, som platinelektroden i figur \(\Sideindeks{3}\), deltager ikke i iltningsreduktionsreaktionen og er til stede, så strømmen kan strømme gennem cellen. Platin eller guld gør generelt gode inerte elektroder, fordi de er kemisk ureaktive.
eksempel \(\Sideindeks{1}\): Brug af Cellenotation
overvej en galvanisk celle bestående af
\
skriv iltnings-og reduktionshalvreaktionerne og skriv reaktionen ved hjælp af cellenotation. Hvilken reaktion forekommer ved anoden? Katoden?
opløsning
ved inspektion iltes Cr, når tre elektroner går tabt for at danne Cr3+, og Cu2+ reduceres, da det får to elektroner til at danne Cu. Balancering af ladningen giver
\
Cellenotation bruger den enkleste form for hver af ligningerne og starter med reaktionen ved anoden. Ingen koncentrationer blev specificeret således:
\
iltning forekommer ved anoden og reduktion ved katoden.
eksempel \(\Sideindeks{2}\): Brug af Cellenotation
overvej en galvanisk celle bestående af
skriv iltnings-og reduktionshalvreaktionerne og skriv reaktionen ved hjælp af cellenotation. Hvilken reaktion forekommer ved anoden? Katoden?
opløsning
ved inspektion gennemgår Fe2+ iltning, når en elektron går tabt for at danne Fe3+, og MnO4− reduceres, da den får fem elektroner til at danne Mn2+. Balancering af ladningen giver
\
Cellenotation bruger den enkleste form for hver af ligningerne og starter med reaktionen ved anoden. Det er nødvendigt at anvende en inert elektrode, såsom platin, fordi der ikke er noget metal til stede for at lede elektronerne fra anoden til katoden. Ingen koncentrationer blev specificeret således:
\
iltning forekommer ved anoden og reduktion ved katoden.
øvelse \(\Sideindeks{1}\)
brug cellenotation til at beskrive den galvaniske celle, hvor kobber(II) ioner reduceres til kobbermetal, og sinkmetal iltes til sinkioner.
svar
fra oplysningerne i problemet:
\
brug af cellenotation:
\
oversigt
elektrokemiske celler består typisk af to halvceller. Halvcellerne adskiller iltningshalvreaktionen fra reduktionshalvereaktionen og gør det muligt for strøm at strømme gennem en ekstern ledning. En halvcelle, der normalt er afbildet på venstre side i en figur, indeholder anoden. Iltning sker ved anoden. Anoden er forbundet med katoden i den anden halvcelle, ofte vist på højre side i en figur. Reduktion sker ved katoden. Tilføjelse af en saltbro fuldender kredsløbet, så strømmen kan strømme. Anioner i saltbroen strømmer mod anoden, og kationer i saltbroen strømmer mod katoden. Bevægelsen af disse ioner fuldender kredsløbet og holder hver halvcelle elektrisk neutral. Elektrokemiske celler kan beskrives ved hjælp af cellenotation. I denne notation vises information om reaktionen ved anoden til venstre og information om reaktionen ved katoden til højre. Saltbroen er repræsenteret af en dobbelt linje, L. A. De faste, flydende eller vandige faser inden for en halvcelle adskilles af en enkelt linje, liter. Fasen og koncentrationen af de forskellige arter er inkluderet EFTER artsnavnet. Elektroder, der deltager i iltningsreduktionsreaktionen, kaldes aktive elektroder. Elektroder, der ikke deltager i iltningsreduktionsreaktionen, men er der for at tillade strøm at strømme, er inerte elektroder. Inerte elektroder fremstilles ofte af platin eller guld, som er uændrede ved mange kemiske reaktioner.
ordliste
aktiv elektrodeelektrode, der deltager i iltningsreduktionsreaktionen af en elektrokemisk celle; massen af en aktiv elektrode ændres under iltningsreduktionsreaktionen anodeelektrode i en elektrokemisk celle, hvor iltningen forekommer; oplysninger om anoden registreres på venstre side af saltbroen i cellenotation katodeelektrode i en elektrokemisk celle, hvor reduktion forekommer; oplysninger om katoden registreres på højre side af saltbroen i cellenotation cellenotation stenografisk måde at repræsentere reaktionerne i en elektrokemisk cellecellepotentialeforskel i elektrisk potentiale, der opstår, når forskellige metaller er forbundet med hinanden, når de; elektrokemiske celler med positive cellepotentialer; også kaldet en voltaisk celle inert elektrodeelektrode, der tillader strøm at strømme, men som ellers ikke deltager i iltningsreduktionsreaktionen i en elektrokemisk celle; massen af en inert elektrode ændres ikke under iltningsreduktionsreaktionen i en elektrokemisk celle; massen af en inert elektrode ændres ikke under iltningsreduktionsreaktionen; inerte elektroder er ofte lavet af platin eller guld, fordi disse metaller er kemisk ureaktive. voltaisk celle et andet navn for en galvanisk celle
bidragydere og tilskrivninger
-
Paul Blomster (University of North Carolina – Pembroke), Klaus Theopold (University of delvar) og Richard Langley (Stephen F. Austin State University) med bidragende forfattere. Indhold i lærebogen, der er produceret af Creative Commons Attribution License 4.0, er licenseret under en Creative Commons Attribution License 4.0-licens. Hent gratis på http://cnx.org/contents/85abf193-2bd…[email protected]).