hybridiseringsteorien ses ofte som et langt og forvirrende koncept, og det er en praktisk færdighed at være i stand til hurtigt at afgøre, om atomet er sp3, sp2 eller sp uden at skulle gennemgå alle detaljer om, hvordan hybridiseringen var sket.
heldigvis er der en genvej i at gøre dette, og i dette indlæg vil jeg forsøge at opsummere dette i et par forskellige trin, som du skal følge.
lad os sige, at du bliver bedt om at bestemme hybridiseringstilstanden for de nummererede atomer i følgende molekyle:

det første du skal gøre er at bestemme antallet af de grupper, der er på hvert atom. Ved grupper mener vi enten atomer eller ensomme par elektroner. Dette er også kendt som sterisk nummer (SN).

nedenfor er et par eksempler på steriske tal 2-4, som stort set er det, du har brug for at vide i organisk kemi:

Bemærk, at flere bindinger ikke betyder noget, det er atomer + ensomme par for enhver bindingstype.
Når du ved, hvordan du bestemmer det steriske tal (det er fra VSEPR – teorien), skal du blot anvende følgende korrelation:
hvis det steriske tal er 4, er det sp3
hvis det steriske tal er 3 – sp2
hvis det steriske tal er 2-SP
så nu, lad os gå tilbage til vores molekyle og bestemme hybridiseringstilstandene for alle atomer.
C1 – SN = 3 (tre atomer forbundet), derfor er det sp2
C2 – SN = 3 (tre atomer forbundet), derfor er det sp2
O4 – SN = 3 (1 atom + 2 ensomme par), derfor er det sp2
O5 – SN = 4 (2 atomer + 2 ensomme par), derfor er det sp3
C6 – SN = 4 (4 atomer), derfor er det det er SP3
C7 – SN = 4 (4 atomer), derfor er det SP3
N8 – SN = 4 (3 atomer + 1 Lone par), derfor er det SP3
C9 – sn = 2 (2 atomer), derfor er det sp
C10 – SN = 2 (2 atomer), derfor er det SP

ud over denne metode er det også meget nyttigt at huske nogle træk relateret til strukturen og hybridiseringen. Generelt er et atom med alle enkeltbindinger en sp3 hybridiseret. Det bedste eksempel er alkanerne. Alle carbonatomer i en alkan er SP3 hybridiseret med tetrahedral geometri.
kulstofferne i alkener og andre atomer med en dobbeltbinding er ofte SP2 hybridiserede og har trigonal plan geometri.
den tredobbelte binding er derimod karakteristisk for alkyner, hvor carbonatomerne sp-hybridiseres.
der er nogle få almindelige undtagelser fra det, vi har diskuteret om bestemmelse af hybridiseringstilstanden, og de er for det meste relateret til metoden, hvor vi ser på atomets bindingstype.
for eksempel i kulstof (CO2) har carbonet to dobbeltbindinger, men det er sp-hybridiseret.
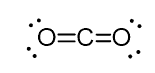
og årsagen til dette er, at carbonets steriske nummer er to (der er kun to atomer af ilt forbundet til det) og for at holde to atomer ved 180o, hvilket er den optimale geometri, skal carbonet bruge to identiske orbitaler. Dette er kun muligt i sp-hybridiseringen. De to andre 2P orbitaler bruges til at fremstille dobbeltbindingerne på hver side af kulstoffet.
et andet almindeligt og meget vigtigt eksempel er carbocations.

Her har carbonet kun enkeltbindinger, og det kan se ud som om det skal være SP3 hybridiseret. Imidlertid er carbon i denne type carbocations SP2 hybridiseret. Igen af samme grund, at dets steriske tal er 3 (sp2 – tre identiske orbitaler).
en undtagelse fra den steriske Nummermetode
en undtagelse med det steriske tal er for eksempel amiderne. Nitrogenatomet her har sterisk nummer 4 og forventes at sp3. På grund af resonansdelokaliseringen af det ensomme par interkonverterer det imidlertid fra sp3 til sp2, da det er den eneste måde at have elektronerne i en justeret p-orbital, der kan overlappe og deltage i resonanstabilisering med pi-bindingselektronerne i c=o-dobbeltbindingen.

i de fleste tilfælde behøver du ikke bekymre dig om undtagelserne, hvis du går baseret på det steriske nummer.