mekanismer for katalyse
bindingen af et substrat til det aktive sted for et ferment er en meget specifik interaktion. Aktive steder er spalter eller riller på overfladen af et ferment, normalt sammensat af aminosyrer fra forskellige dele af polypeptidkæden, der bringes sammen i den tertiære struktur af det foldede protein. Substrater binder oprindeligt til det aktive sted ved ikke-kovalente interaktioner, herunder hydrogenbindinger, ionbindinger og hydrofobe interaktioner. Når et substrat er bundet til det aktive sted, kan flere mekanismer fremskynde dets omdannelse til reaktionsproduktet.
selvom det enkle eksempel, der blev diskuteret i det foregående afsnit, kun involverede et enkelt substratmolekyle, involverer de fleste biokemiske reaktioner interaktioner mellem to eller flere forskellige substrater. For eksempel involverer dannelsen af en peptidbinding sammenføjningen af to aminosyrer. For sådanne reaktioner accelererer bindingen af to eller flere substrater til det aktive sted i den korrekte position og orientering reaktionen (figur 2.23). Det giver en skabelon, hvorpå reaktanterne bringes sammen og orienteres korrekt for at favorisere dannelsen af overgangstilstanden, hvor de interagerer.

figur 2.23
katalyse af en reaktion mellem to substrater. Det giver en skabelon, hvorpå de to substrater bringes sammen i den korrekte position og orientering til at reagere med hinanden. ved at ændre konformationen af deres substrater for at nærme sig overgangstilstanden. Den enkleste model for interaktion mellem substrat og substrat er lock-and-key-modellen, hvor substratet passer præcist ind i det aktive sted (figur 2.24). I mange tilfælde modificeres konfigurationerne af både substratet og substratet ved substratbinding – en proces kaldet induceret pasform. I sådanne tilfælde ændres konformationen af substratet, så det mere ligner overgangstilstanden. Den spænding, der frembringes ved en sådan forvrængning af substratet, kan yderligere lette dets omdannelse til overgangstilstanden ved at svække kritiske bindinger. Desuden stabiliseres overgangstilstanden ved dens stramme binding til fsymet, hvorved den krævede aktiveringsenergi sænkes.

figur 2.24
modeller for interaktion mellem substrater. (A) I lock-and-key-modellen passer substratet nøjagtigt ind i det aktive sted for det aktive stof. B) i den inducerede fit-model forvrider substratbinding konformationerne af både substrat og f.eks. Denne forvrængning (mere…ud over at bringe flere substrater sammen og fordreje konformationen af substrater for at nærme sig overgangstilstanden, deltager mange forskellige stoffer direkte i den katalytiske proces. I sådanne tilfælde kan specifikke aminosyresidekæder på det aktive sted reagere med substratet og danne bindinger med reaktionsmellemprodukter. De sure og basiske aminosyrer er ofte involveret i disse katalytiske mekanismer, som illustreret i den følgende diskussion af chymotrypsin som et eksempel på katalyse.Chymotrypsin er medlem af en familie af serinproteaser, der fordøjer proteiner ved at katalysere hydrolysen af peptidbindinger. Reaktionen kan skrives som følger:

de forskellige medlemmer af serinproteasefamilien (inklusive chymotrypsin, trypsin, elastase og thrombin) har forskellige substratspecifikationer; de spalter fortrinsvis peptidbindinger ved siden af forskellige aminosyrer. For eksempel, mens chymotrypsin fordøjer bindinger ved siden af hydrofobe aminosyrer, såsom tryptophan og phenylalanin, fordøjer trypsin bindinger ved siden af basiske aminosyrer, såsom lysin og arginin. Alle serinproteaser er imidlertid ens i struktur og bruger den samme katalysemekanisme. De aktive steder indeholder tre kritiske aminosyrer—serin, histidin og aspartat—der driver hydrolyse af peptidbindingen. Faktisk kaldes disse serinproteaser på grund af serinrest ‘ s centrale rolle.substrater binder til serinproteaserne ved at indsætte aminosyren ved siden af spaltningsstedet i en lomme på det aktive sted (figur 2.25). Arten af denne lomme bestemmer substratspecificiteten af de forskellige medlemmer af serinproteasefamilien. For eksempel indeholder bindingslommen af chymotrypsin hydrofobe aminosyrer, der interagerer med de hydrofobe sidekæder af dets foretrukne substrater. I modsætning hertil indeholder bindingslommen af trypsin en negativt ladet sur aminosyre (aspartat), som er i stand til at danne en ionbinding med lysin-eller argininresterne af dets substrater.
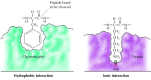
figur 2.25
substratbinding af serinproteaser. En af de mest almindelige typer af peptidbindinger, der bruges til at nedbryde peptidbindinger, er en del af det aktive stof. I chymotrypsin binder lommen hydrofobe aminosyrer; den bindende lomme af trypsin indeholder (mere…)
substratbinding placerer peptidbindingen, der skal spaltes ved siden af det aktive sted serin (figur 2.26). Protonen af denne serin overføres derefter til det aktive sted histidin. Konformationen af det aktive sted favoriserer denne protonoverførsel, fordi histidinet interagerer med den negativt ladede aspartatrest. Serinen reagerer med substratet og danner en tetrahedral overgangstilstand. Den peptid bond er derefter spaltes, og den C-terminale del af det substrat, der er frigjort fra enzymet. Imidlertid forbliver det N-terminale peptid bundet til serin. Denne situation løses, når et vandmolekyle (det andet substrat) kommer ind i det aktive sted og reverserer de foregående reaktioner. Protonen af vandmolekylet overføres til histidin, og dets hydroksylgruppe overføres til peptidet, hvilket danner en anden tetrahedral overgangstilstand. Protonen overføres derefter fra histidin tilbage til serin, og peptidet frigives fra f.eks.

figur 2.26
katalytisk mekanisme af chymotrypsin. Tre aminosyrer på det aktive sted (Ser-195, His-57 og Asp-102) spiller kritiske roller i katalyse. dette eksempel illustrerer adskillige træk ved katalyse; specificiteten af interaktioner mellem substrater, placeringen af forskellige substratmolekyler på det aktive sted og involveringen af rester fra det aktive sted i dannelsen og stabiliseringen af overgangstilstanden. Selv om tusindvis af celler katalyserer mange forskellige typer kemiske reaktioner, gælder de samme grundlæggende principper for deres funktion.