
eksempel 1:
et af de mest kendte eksempler på et molekyle, hvor bindingselektroner er delokaliseret, er bensene, vist nedenfor:
Bensene består af en ring af seks carbonatomer atom. Carbonatomerne er alle sp2 hybridiseret med en uhybridiseret p orbital.
sp2 hybrid orbitaler producerer normale kovalente bindinger, nogle gange kaldet Kurt-bindinger: disse er de enkelte C-C-bindinger og enkelt C-H-bindinger.
dette efterlader hvert kulstof med en elektron i en p-orbital i en ret vinkel i forhold til ringens plan.
i diagrammet nedenfor kan du se sp2-orbitalerne, der danner kovalente bindinger. Til højre kan du se p-orbitalerne, som hver indeholder en elektron.
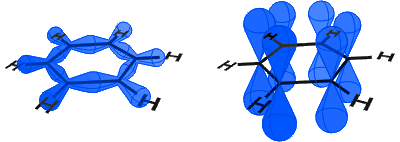
p-orbitalerne kombinerer side på, og elektronerne i p-orbitalerne beskrives som kurp-elektroner.
i diagrammet nedenfor har p-orbitalerne kombineret, og de russiske elektroner er delokaliseret. I gennemsnit er alle ringbindene identiske.
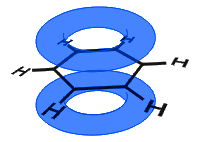
i modsætning til i det næste eksempel nedenfor holdes de delokaliserede elektroner i bensene inden i molekylet og er ikke fri til at bevæge sig gennem bulkmaterialet.
eksempel 2: metaller har høj termisk og elektrisk ledningsevne, fordi de yderste elektroner i deres atomer er delokaliseret. Disse elektroner er ikke forbundet med nogen bestemt metallisk kerne, og så er fri til at bevæge sig gennem metallet.de blå farvede billeder af orbitalerne er venligst udlånt af Sansculotte. Disse billeder er licenseret under Creative Commons Attribution-Share Alike 1.0 Generisk licens.