en voltaisk celle, ofte kendt som en galvanisk celle, giver elektrisk energi. Kilden til denne energi er en spontan kemisk reaktion, mere specifikt en spontan reaktion.
for eksempel er alle batterier lavet af en eller flere voltaiske celler;batterier går fladt, når de fleste eller alle deres reaktanter er blevet omdannet til produkter og omdanner deres kemiske potentielle energi til elektrisk energi.
voltaiske celler – den grundlæggende proces
kemisk potentiel energi-elektrisk energi
den voltaiske celle er en af to grundlæggende typer elektrokemiske celler.Den anden type er den elektrolytiske celle; i en elektrolytisk celle bruges elektrisk energi til at drive en ikke-spontan kemisk reaktion.For eksempel kan vand opdeles i brint og ilt i en elektrolytisk celle. Når et genopladeligt batteri genoplades, fungerer det også som en elektrolytisk celle.
Basic Voltaic Cell skematisk
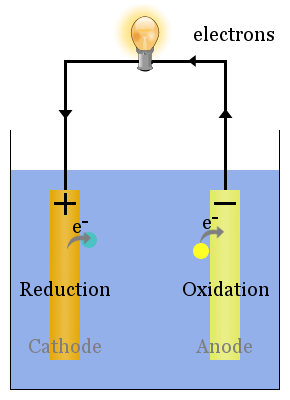
spontane reduktionsreaktioner ved elektroderne producerer en spænding.Korrekt konfigureret kan denne spænding drive elektroner gennem elektriske enheder, såsom den viste pære here.In dette diagram, arter overfører elektroner til anoden, hvorfra de strømmer gennem lyspæren til katoden, hvor de medfører reduktion.
grundlæggende elektrolytisk Celleskematisk
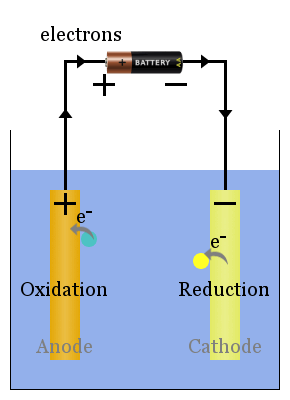
ikke-spontan reaktionerne drives af en ekstern spænding.Den elektrolytiske celles processer er det modsatte af den voltaiske celle.strømmen fra strømkilden skubber elektroner videre til katoden, hvor de får reduktion af arter til at finde sted.
Læs mere her om katoder og anoder i voltaiske vs elektrolytiske celler.
eksempel på en Voltaisk celle
Edison-batteriet
Edison-batteriet er en simpel, Genopladelig celle opfundet af Thomas Edison.It består af to metalelektroder, den ene lavet af jern, den anden af nikkel.Under den første opladning dannes en belægning af nikkelilte på nikkelelektroden.
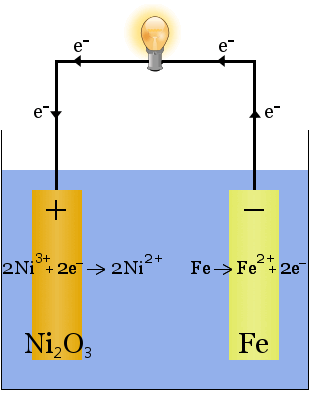
elektrolytten (den ioniske væske mellem elektroderne) er 20-30 vægtprocent kaliumhydroksid i vand.I dette tilfælde er den ioniske ledningsevne øget for at fuldføre det elektriske kredsløb – kaliumhydroksid forbruges ikke i reaktionen.
når den udledes, fungerer Edison-cellen som en voltaisk celle.Når den oplades, fungerer cellen som en elektrolytisk celle.
de kemiske ligninger for reaktionerne ved elektroderne er:
under afladning, når cellen leverer elektrisk energi, fortsætter reaktionerne ovenfor til højre Karr.
under opladning, når cellen konverterer elektrisk energi til kemisk potentiel energi, fortsætter reaktionerne ovenfor til venstre.
Edison-cellen, med begge elektroder, der deler den samme elektrolyt, er en af de enkleste voltaiske celler i praktisk brug; de fleste voltaiske celler er mere komplicerede.Dens store fordele er dens bemærkelsesværdige robusthed mod fejl som overopladning og dens meget lange arbejdsliv med næsten ubegrænset opladning.
den største ulempe er, at den i forhold til dens energiproduktion er meget tung.
yderligere eksempel
lithiumbatterier
fremskridt inden for batteriteknologi har drevet miniaturisering af elektroniske enheder.Uden disse fremskridt ville moderne enheder som mobiltelefoner og tablets være større og mere besværlige.
kernen i disse fremskridt har været lithium-ion-teknologi.Elementet lithium er et metal med meget lav densitet: ved 0,534 g/cm3 er lithium halvt så tæt som vand; lithium flyder på vand.Sammenlign dette med metallerne i Edison-cellen, nikkeltætheden er 8,908 g/cm3, og jern er 7,874 g / cm3: disse er mere end 10 gange højere end lithiums densitet.
lithiums høje potentiale kombineret med dets lave densitet gør dets ioner perfekte til brug som batterimateriale.
et typisk lithiumionbatteri er baseret på porøse elektroder, der tillader Li-ioner at bevæge sig ind og ud af deres porer.For eksempel kan et genopladeligt lithiumionbatteri have en grafitelektrode og en lithiumdoteret koboltelektrode med en polyoksyethylenelektrolyt indeholdende saltet LiPF6.
når et sådant batteri driver en enhed, iltes lithiumatomer, der holdes inden i lagstrukturen af grafitanode, til at blive ioner.
ved katoden reduceres lithiumioner inden for koboltoksidstrukturen.
These reactions are reversed when the cell is being charged.
