et godt udgangspunkt for, hvornår du skal finde elektronkonfigurationen af en ion, er elektronkonfigurationen af det neutrale atom.
i dit tilfælde skal du finde elektronkonfigurationen af fluoranionen, #”F”^ ( -)#, så start med at skrive elektronkonfigurationen af et neutralt fluoratom, #”F”#.
fluor er placeret i Periode 2, gruppe 17 i det periodiske system og har et atomnummer på #9#. Dette fortæller dig, at det neutrale fluoratom har i alt #9# elektroner, der omgiver dens kerne.
dens elektronkonfiguration vil være
# ” F:”1s^2 2s^2 2p^5#
nu dannes #” F ” ^ ( -)# anion, når #1# Elektron tilsættes til et neutralt fluoratom.
Bemærk, at 2P-subshell af det neutrale atom indeholder #5# elektroner. Dens maksimale kapacitet er faktisk # 6 # elektroner, to elektroner for hver p-orbital.
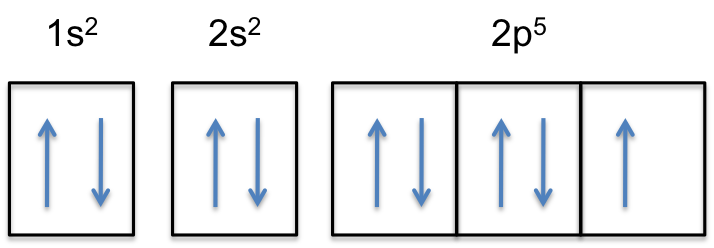
dette betyder, at #color(red)(“ekstra electron”)# vil blive tilføjet til en af de tre 2P-orbitaler, lad os sige til #2p_y#.
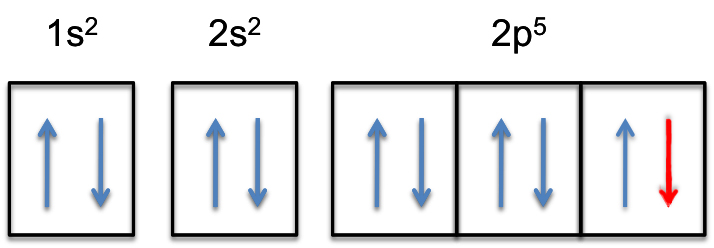
2p-subshell vil nu være helt fyldt, dvs.det vil holde #6# elektroner.
elektronkonfigurationen af fluoranionen vil således være
#farve(grøn)(|bar(ul(Farve(Hvid)(a/a)Farve(Sort)(“F”^( -):Farve(Hvid) (a) 1s^2farve(Hvid) (a) 2s^2 Farve(Hvid) (a)2p^6)Farve(Hvid) (a/a)|)))#
Bemærk, at fluoranionen har i alt #8# elektroner i sin anden skal, den yderste skal. Dette fortæller dig, at anionen har en komplet oktet.
fordi fluoranionen er isoelektronisk med neon, #”Ne”#, kan du skrive dens elektronkonfiguration ved hjælp af ædelgas stenografi notation som
#”f”^(-): #
Her
## – elektronkonfigurationen af neon