Nå, overvej delokalisering af elektrondensitet. Det er når elektrondensiteten spredes så meget som muligt gennem et molekyle, så den mindste ladningsopbygning er til stede i en given orbital.
det er beskrevet:
- samlet af alle resonansbidragere i strukturer.
- kollektivt af alle de individuelle molekylære orbitale bidrag i molekylære orbitale diagrammer.
(Der er subtile forskelle mellem disse, men disse er omtrent analoge for enkelhed. Se her for flere detaljer.)
lokalisering af elektrondensitet er manglen på det.
det er, når vi fylder al elektrondensiteten i et par orbitaler i stedet for at sprede den ud, og det sker næsten aldrig rigtig i et rigtigt molekyle eller kvantesystem (selvom der ikke er nogen resonans).
eksempel med RESONANSTRUKTURER
Overvej den isolerede (ikke-reagerende) allylkation, #”C”_3″H”_5^(+)#.
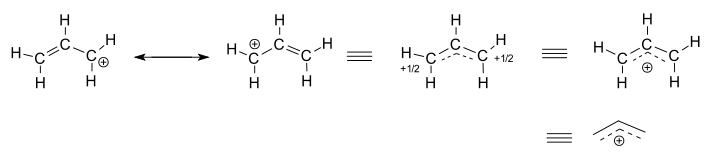
- de venstre to strukturer er resonansbidragere, som hver er lokaliserede repræsentationer af den sande delokaliserede struktur.
- de tre højre strukturer er hver repræsentationer af resonanshybridstrukturen eller den delokaliserede struktur.
den delokaliserede struktur er grundlæggende beskrevet af en samling af bindingsmolekylære orbitaler.
eksempel med et molekylært ORBITALDIAGRAM
overvej allylkationen igen i et Mo-diagram, der kun beskriver #bbpi# elektronerne (dvs. elektronerne, der ville være i en #pi# binding i en lokaliseret dobbeltbinding!), men tillader deltagelse i reaktioner:
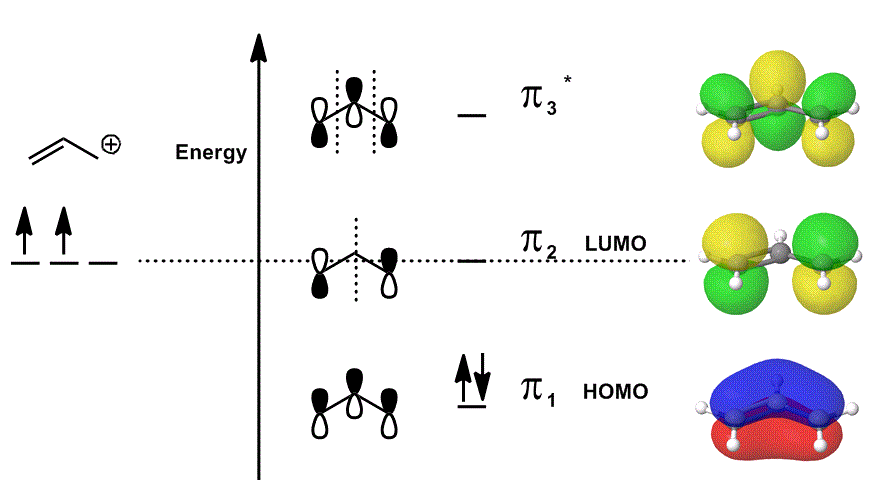
- hver af orbitalbidragene i midten er afbildet lokaliseret; atomorbitalerne, der ville overlappe hinanden, vises som sig selv (fase inkluderet).
- hver af orbitalerne yderst til højre (en pr. række) er afbildet delokaliseret; elektrondensiteten får lov til at sprede sig, så de molekylære orbitaler er afbildet med fuldstændig overvejelse af overlapninger, noder og faser.
Når du overlapper # pi_1#, # pi_2 # og # pi_3^”* ” # og inkorporerer det vægtede bidrag fra disse tilstande (vægtet i henhold til koefficienterne #c_i#), får du den lineære kombination af molekylære orbitaler:
#psi_(“allyl”^(+)) = c_1overbrace(pi_1)^”bonding” + c_2overbrace(pi_2)^”nonbonding” + c_3overbrace(pi_3^”*”)^”antibonding”#
og #Psi_(“allyl”^(+))# derefter beskriver den samlede fordeling af tilstande, der kollektivt beskriver reaktiviteten af allylkationen.
med andre ord, #pi_1# (som donerer #pi# elektroner til binding), #pi_2# (som accepterer elektroner til binding) og #pi_3^”*”# (i dette tilfælde deltager det sjældent) alle gør noget, når allylkationen deltager i en kemisk reaktion, fordi (hvis de er optaget), eksisterer de på samme tid.