den reversible udvidelse af en ideel gas kan bruges som et eksempel på en isobarisk proces. Af særlig interesse er den måde, hvorpå varme omdannes til arbejde, når ekspansion udføres ved forskellige arbejdsgas/omgivende gastryk.
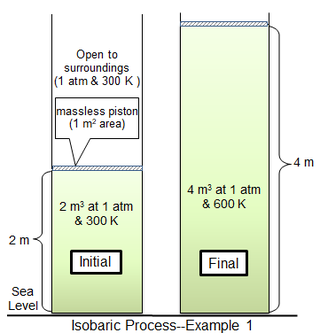
i det første proceseksempel omslutter et cylindrisk kammer 1 m2 i området 81.2438 mol af en ideel diatomisk gas med molekylvægt 29 g mol−1 ved 300 K. Den omgivende gas er på 1 atm og 300 K og adskilt fra cylindergassen med et tyndt stempel. For det begrænsende tilfælde af et masseløst stempel er cylindergassen også ved 1 atm-tryk med et indledende volumen på 2 m3. Varme tilsættes langsomt, indtil gastemperaturen er ensartet 600 K, hvorefter gasvolumenet er 4 m3 og stemplet er 2 m over dets oprindelige position. Hvis stempelbevægelsen er tilstrækkelig langsom, vil gastrykket i hvert øjeblik have praktisk talt den samme værdi (psys = 1 atm) overalt.
for en termisk perfekt diatomisk gas er den molære specifikke varmekapacitet ved konstant tryk (cp) 7/2R eller 29.1006 J mol−1 deg−1. Den molære varmekapacitet ved konstant volumen (cv) er 5/2R eller 20.7862 J mol−1 deg−1. Forholdet mellem {\displaystyle \ gamma }

af de to varmekapaciteter er 1,4.
den varme, der kræves for at bringe gassen fra 300 til 600 K, er
K = liter H = n c P liter T = 81.2438 × 29.1006 × 300 = 709 , 274 J {\displaystyle S={\Delta\mathrm {H} }=n\, c_{p}\, \ Delta \ mathrm {T} =81.2438 \ gange 29.1006\times 300=709.274{\tekst{ J}}}

.
stigningen i den interne energi er
liter u = n c v liter T = 81.2438 × 20.7862 × 300 = 506 , 625 J {\displaystyle \Delta \ U=n\,c_{v}\,\Delta \mathrm {t} =81.2438\gange 20.7862\gange 300=506.625{\tekst{ J}}}

derfor, B = K − L = 202 , 649 J = n R L {\displaystyle B=K-\Delta U=202,649{\tekst{ J}}=nR\Delta \mathrm {t} }

også
v = P L = 1 atm L = 2 m3 l=101325 pa=202 , 650 j {\displaystyle v={p\delta \nu}=1~{\tekst{ATM}}\gange 2{\tekst{m3}}\gange 101325{\tekst{pa}}=202.650{\tekst{ j}}}

, som selvfølgelig er identisk med forskellen mellem Lusha og Lusha.
Her er arbejdet helt opslugt af ekspansion mod omgivelserne. Af den samlede påførte varme (709,3 kJ) er det udførte arbejde (202,7 kJ) ca.28,6% af den tilførte varme.

det andet proceseksempel ligner det første, bortset fra at det masseløse stempel erstattes af et med en masse på 10.332.2 kg, hvilket fordobler cylindergasens tryk til 2 atm. Cylindergasvolumenet er derefter 1 m3 ved den indledende 300 K temperatur. Varme tilsættes langsomt, indtil gastemperaturen er ensartet 600 K, hvorefter gasvolumenet er 2 m3 og stemplet er 1 m over dets oprindelige position. Hvis stempelbevægelsen er tilstrækkelig langsom, vil gastrykket i hvert øjeblik have praktisk talt den samme værdi (psys = 2 atm) overalt.
da entalpi og intern energi er uafhængige af tryk,
K = H = 709 , 274 j {\Delta\mathrm {H}}=709,274 {\tekst {J}}}

og list u=506 , 625 J {\displaystyle\Delta U = 506,625 {\tekst {J}}}

. V = P-V = 2 atm-v = 1 m3-101325 Pa=202 , 650 J {\displaystyle V={p\Delta V}=2~{\tekst{atm}}\gange 1~{\tekst{m3}}\gange 101325{\tekst{Pa}}=202.650{\tekst{ J}}}

som i det første eksempel konverteres omkring 28,6% af den leverede varme til arbejde. Men her anvendes arbejdet på to forskellige måder: dels ved at udvide den omgivende atmosfære og dels ved at løfte 10.332, 2 kg en afstand h på 1 m.
v l i F T = 10 332,2 kg L 9.80665 m / s2 1 m = 101, 324 J {\displaystyle V_ {\rm {lift}}=10\,332.2~{\tekst{kg}} \ gange 9.80665~{\tekst{m / s2}} \ gange 1 {\tekst{m}}=101,324 {\tekst{ J}}}

således løfter halvdelen af arbejdet stempelmassen (tyngdekraftsarbejde eller “brugbart” arbejde), mens den anden halvdel udvider omgivelserne.
resultaterne af disse to proceseksempler illustrerer forskellen mellem den brøkdel af varme, der omdannes til brugbart arbejde (mg lysh) vs. fraktionen konverteret til trykvolumen arbejde udført mod den omgivende atmosfære. Det anvendelige arbejde nærmer sig nul, når arbejdsgastrykket nærmer sig omgivelserne, mens maksimalt brugbart arbejde opnås, når der ikke er noget omgivende gastryk. Forholdet mellem alt udført arbejde og varmeindgangen til ideel isobarisk gasudvidelse er
B = N R-T N C p-T = 2 5 {\displaystyle {\frac {b}{b}}}={\frac {nR\Delta \mathrm {t}} {nc_{p}\Delta \mathrm {t}}} ={\frac {2} {5}}}
