US Pharm. 2008; 33 (4) (onkologi suppl): 20-30. 75% af postmenopausale kvinder med brystkræft har hormonreceptorpositiv (HR+) sygdom.1 Tamoksifen var standarden for behandling af HR + brystkræft hos postmenopausale kvinder indtil fremkomsten af de selektive tredje generations aromatasehæmmere, som er anastrosol, letrosol og eksemestan.3,4 disse midler har vist overlegen sygdomsfri overlevelse i kliniske forsøg sammenlignet med tamoksifen, men deres fordel, når de anvendes i mere end fem år hos postmenopausale kvinder med HR+ brystkræft, er ikke fastlagt.3,4
det er blevet estimeret, at tre fjerdedele af postmenopausale kvinder med brystkræft har hormonreceptorpositiv (HR+) sygdom.1 Tamoksifen–en selektiv østrogen-receptor modulator med østrogene virkninger på knogle, endometrievæv, og lipider og anti!= østrogene virkninger på brystvæv-var standardterapi for HR+ brystkræft hos postmenopausale kvinder indtil introduktionen af de selektive tredje generation aromatasehæmmere (AIs).2-4 disse stoffer har vist overlegen sygdomsfri overlevelse (DFS) sammenlignet med tamoksifen i kliniske forsøg.3,4 bivirkninger forbundet med brugen af tamoksifen-endometriecancer, tromboemboliske komplikationer og tamoksifenresistens-har tilskyndet til udvikling af terapier med en anden virkningsmekanisme, såsom AIs.2
se tabel 1 for en oversigt over vigtige oplysninger om tredje generation AIs.
baggrund
Den Skotske kirurg George Beatson beskrev det hormonelle bidrag fra østrogener til carcinogenese i forhold til brystkræft i 1896.5 Beatson erkendte, at fjernelse af æggestokkene (oophorektomi) var gavnlig hos kvinder med kræft i æggestokkene, og at det var inoperabel brystkræft.5 Denne kirurgisk inducerede tilstand af østrogenmangel bidrog til inhiberingen af tumorvækst i brystkræftceller hos kvinder med HR+ sygdom.5
Aminoglutethimid, oprindeligt formuleret som et antikonvulsivt middel, var den første uspecifikke AI, der oprindeligt blev fremmet i slutningen af 1970 ‘ erne som et andetlinjemiddel efter tamoksifen til postmenopausale kvinder med avanceret HR+ brystkræft.6 toksiske bivirkninger såsom binyrebarksuppression og nødvendigheden af steroidbehandling førte til tilbagetrækning af aminoglutethimid fra markedet.6 hos postmenopausale kvinder med tidlig og sen fase HR+ brystkræft viser tredje generation AIs en bedre toksicitetsprofil, mere selektivitet, højere styrke og forbedret klinisk effekt sammenlignet med de ældre stoffer. 6
Klassificering4,7
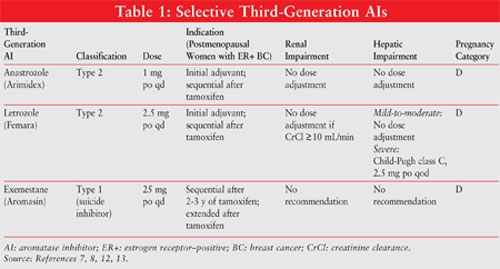
AIs er klassificeret som type 1 steroide (ikke-konkurrencedygtige, irreversible) eller type 2 ikke-steroide (konkurrencedygtige, reversible) hæmmere. Eksemestan, en type 1-hæmmer, binder irreversibelt til stedet på aromatasemolekylet og er kendt som en selvmordshæmmer. Type 2-hæmmere binder reversibelt til aromatase. Se figur 1 For de kemiske strukturer i de forskellige AIs.
virkningsmekanisme
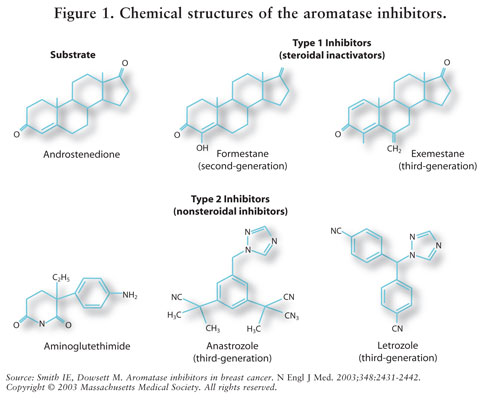
østrogensyntese medieres af aromatasen.7 Aromatase omdanner androstenedion og testosteron til estron og østradiol.5,7 AIs reducerer østrogen hos postmenopausale kvinder og derved hæmmer dets kræftfremkaldende virkning på brystvæv.7 da æggestokkene hos præmenopausale kvinder stadig fungerer, er AIs ikke indiceret til denne population uden for kliniske forsøg; hos disse kvinder ville AIs stimulere hypothalamus og hypofysen til at øge produktionen af gonadotropiner.4 Se figur 2.
Toksiciteter6,8
bivirkninger af AIs inkluderer kardiovaskulær dysfunktion såsom hypertension, vasodilatation, ødem, og brystsmerter. Yderligere undersøgelse er nødvendig for at evaluere den fulde effekt af AIs på hjertefunktionen. Patienter kan opleve nedsat knoglemineraltæthed (BMD), øget risiko for brud, vasomotoriske symptomer, vaginal tørhed, muskuloskeletale smerter, hovedpine, søvnløshed, depression, øget hoste, dyspnø, gastrointestinalt ubehag, vægtøgning og muligvis forhøjede lipidniveauer. Knogletab er en overvejende bivirkning; bisfosfonater, som f.eks. Patienter på AIs bør modtage vitamin D og calciumtilskud. Langvarige bivirkninger og virkninger på kognitiv funktion fra AI-terapi er endnu ikke bestemt.9 AIs er kontraindiceret hos gravide kvinder. CYP1A2, CYP2C9 og CYP3A4.10,11 metaboliseres af CYP2A6 og CYP2C19, og eksemestan metaboliserer CYP3A4.8,10-13 induktorer af CYP3A4, såsom rifampin, phenytoin, carbamasepin og johannesurt kan medføre et fald i eksemestanniveauer, når de gives samtidig. 8,12,13 Tamoksifen forårsager et fald på 38% i letrosol og et fald på 27% i anastrosol ved samtidig administration.2,7,8,14
indikationer og dosering
Anastrosol 10,11: Anastrosol 1 mg en gang dagligt er indiceret til tidlig brystkræft som initial adjuverende behandling hos postmenopausale kvinder med hormonfølsom sygdom og som første linje for HR+ eller HR-ukendt metastatisk eller lokalt fremskreden sygdom. Det er også godkendt til brug efter tamofen behandling hos kvinder med progressiv sygdom. Dosisjustering er ikke nødvendig ved nedsat nyrefunktion eller let til moderat nedsat leverfunktion.
Letrosol11,12: Letrosol2.5 mg en gang dagligt er indiceret til postmenopausale kvinder med HR+ tidligt stadium brystkræft som initial behandling eller som forlænget adjuvansbehandling efter tamoksifen. Det er også indiceret til HR+ eller HR-ukendt metastatisk sygdom. Dosisjusteringer anbefales ved svært nedsat leverfunktion.
Eksemestan11,14: Eksemestan 25 mg po en gang dagligt er indiceret som adjuverende behandling to til tre år efter tamoksifen for postmenopausale kvinder med HR+ tidlig brystkræft i i alt fem på hinanden følgende års hormonbehandling. Det kan også anvendes til sygdom, der har udviklet sig efter tamofen terapi. Det skal tages efter et måltid. Dosisjustering er unødvendig for nedsat lever-eller nyrefunktion
kliniske forsøg
tamoksifen-relaterede toksiciteter såsom endometriecancer førte til påbegyndelse af store kliniske forsøg, der undersøgte brugen af tredje generation AIs hos postmenopausale kvinder med HR+ brystkræft. Forskellige forsøgsdesign blev brugt til at vurdere ydeevnen af disse midler sammenlignet med tamoksifen.6 overlegne resultater med hensyn til klinisk effektivitet og toksicitetsprofiler etablerede AIs som en ny standard for adjuverende behandling hos postmenopausale kvinder med HR+ brystkræft.6
atac15: ATAC, et multicenter, randomiseret, dobbeltblindet studie, sammenlignede tre behandlingsarme: tamoksifen 20 mg + placebo, 1 mg + tamoksifen placebo og en kombination af tamoksifen 20 mg + anastrosol 1 mg. Det primære mål var at evaluere sikkerheden og effekten af tamoksifen versus tamoksifen og kombinationen af tamoksifen og tamoksifen over fem år. I alt 9.366 patienter-3.125 i armen, 3.116 i armen og 3.125 i kombinationsarmen-blev behandlet i median 33 måneder.
efter tre år viste DFS på 89,4% mod 87,4% for tamoksifen (fareforhold 0,83, 95% CI, P =.013). Den kontralaterale brystcancer (CLBC) faldt sammenlignet med tamoksifen (odds ratio 0,42, 95% CI , P =.007). Kombinationsarmen blev lukket, fordi der ikke blev fundet nogen klinisk fordel ud over tamoksifen. Det var forbundet med bivirkninger såsom endometriecancer (P =.02), vaginal blødning, udledning (P <.0001), cerebrovaskulære hændelser (P =.0006), venøse tromboemboliske hændelser (P =.0006), og hedeture (P <.0001); tamoksifen var forbundet med færre frakturer og mindre ledsmerter (P <.0001). Efter 68 måneder steg DFS (HR 0,87, 95% CI , P =.01) og tid til tilbagefald (HR 0,79, 95% CI , P =.0005) og nedsatte fjernmetastaser (HR 0,86, 95% CI , P =.04) og CLBC (42% fald, P =.01).16 efter et median opfølgningsinterval på 100 måneder viste HR+-patienter forbedringer i DFS (HR 0,85; P =.003), forekomst af CLBC (HR 0,60, P =.004), tid til gentagelse (HR 0,76, P =.0001) og tid til fjern recidiv (HR 0,84, P =.022) sammenlignet med patienter i behandling med tamofen. Den absolutte forskel i tilbagefaldshastigheder forbedret fra 2.8% efter fem år til 4,8% efter ni år. Frakturer var højere under behandlingen, men forskellen faldt væsentligt efter opfølgningsperioden på 100 måneder. Den forlængede behandlingsperiode havde en risiko for brud på 1,15 med tamoksifen versus 1,02. Risikoen for endometriecancer blev reduceret til og fra behandling med tamoksifen, med en årlig rate på henholdsvis 0,043 versus 0,14 og 0,014 versus 0,12. En forskel i samlet overlevelse (OS) er ikke identificeret.
MA.1712,17: mor.17 var et randomiseret, placebokontrolleret, dobbeltblindt forsøg, der vurderede effektiviteten af fem års behandling med letosol hos postmenopausale kvinder med brystkræft, som allerede havde gennemført fem års adjuverende behandling med tamoksifen. Patienterne fik 2,5 mg eller placebo dagligt i fem år. Det primære endepunkt var DFS; sekundære endepunkter var livskvalitet, udvidet sikkerhedsprofil og OS. Af de 5.187 patienter fik 2.593 placebo, og 2.594 fik placebo; median opfølgning var 2,4 år.
i den foreløbige analyse var der 207 lokale eller metastatiske gentagelser af brystkræft eller indledende maligniteter af CLBC, 75 i letrosolgruppen og 132 i placebogruppen. Forventede fire-årige DFS rates kursen for de to grupper var 93% og 87%, henholdsvis (P ?.001 til evaluering af DFS). DFS havde en HR på 0,61 (95% CI , P ?.001). Et fald på 43% i forekomsten af brystkræft (HR 0,57, 95% CI , P =.00008).4 med undtagelse af knudepositive patienter (P =.04) nåede OS ikke statistisk signifikans (HR 0,82, P =.30).4 patienter i armen oplevede vasomotoriske symptomer i lav kvalitet, myalgi og gigt. Osteoporose var mere almindelig (dog ikke signifikant) i armen versus placebo (5,8% vs. 4,5%; P =.07), og brudfrekvensen var sammenlignelig mellem armene. Undersøgelsen blev afsluttet efter en median på 2,4 år på grund af et fald i brystkræfthændelser i armen. Forlænget adjuverende behandling med adjuvans efter afslutning af fem års tamoksifen forbedret DFS.
BIG 1-987,9,18: Breast International Group (BIG) 1-98-undersøgelsen, et dobbeltblindt, multicenter, randomiseret forsøg, indskrev 8.028 postmenopausale kvinder med HR+ brystkræft i det tidlige stadium. Undersøgelsen omfattede fire behandlingsarme, der evaluerede fem års monoterapi, fem års monoterapi, i to år og derefter et skift til monoterapi i tre år eller i to år og derefter et skift til monoterapi i tre år. Det primære mål var DFS; sekundære mål var tid til fjern metastase, sikkerhed og OS. DFS steg hos patienter, der fik tamoksifen sammenlignet med dem , der fik tamoksifen (HR 0,81, 95% CI, relativ reduktion 19%, P =.003), med en absolut forskel på 1,5% efter tre år. (Eller 0,38, P <.0001). Knoglefrakturer blev forøget i letrosolarmen (eller 1,44, P =.006).
IES14,19: Ies (Intergroup Eksemestan-undersøgelse) var en randomiseret, dobbeltblind, multicenter, fase III-undersøgelse, hvis mål var at afgøre, om ændring til eksemestan efter to til tre års tamoksifen var mere effektiv end at fortsætte tamoksifen i fem år. Forsøget omfattede 4.742 postmenopausale kvinder randomiseret til to behandlingsarme; 2.362 forsøgspersoner var planlagt til at skifte til eksemestan 25 mg po en gang dagligt efter to til tre års tamoksifen 20 mg po en gang dagligt for at gennemføre fem års behandling, og de resterende 2.380 var planlagt til at modtage tamoksifen 20 mg po en gang dagligt i fem år. DFS var det primære endepunkt; sekundære endepunkter var OS, udvidet toksicitetsprofil og hyppighed af CLBC.
bivirkninger, der forekom over en median på 30,6 måneder, inkluderede hyppighed af CLBC, lokal eller metastatisk gentagelse og død. Der var 449 begivenheder-183 i den eksemestane arm og 266 i den tamoksifen arm. Eksemestanarmen havde en ujusteret HR på 0,68 (95% CI , P <.001 ved log-rank-testen), som viste et fald på 32% i risiko og var analogt med en fordel i DFS på 4.75 (95% CI) efter tre år. Efter tre år havde eksemestanarmen en DFS på 91,5% (95% CI ) sammenlignet med 86,8% (95% CI ) i armen. Der var ingen signifikant forskel i OS mellem de to grupper med 93 dødsfald i eksemestanarmen og 106 dødsfald i tamoksifenarmen. Der var en signifikant forskel i hyppigheden af CLBC (P =.04) – 20 personer i armen og ni i armen. Brug af eksemestan til at afslutte de fem års behandling efter to til tre års tamoksifen forbedrede DFS sammenlignet med fem års tamoksifen.
forebyggelse af knogletab fra AI-Terapi20
postmenopausale kvinder er tilbøjelige til at udvikle nedsat BMD på grund af reducerede niveauer af østrogen. AI-terapi hos den postmenopausale brystkræftpatient forværrer denne tendens. Denosumab, et fuldt humant monoklonalt undersøgelsesantistof, binder receptoraktivator til nuklear faktor kB ligand (RANKL) og forhindrer RANKL-aktivitet. RANKL er afgørende for osteoklastisk aktivitet, hvilket betyder nedbrydning af knogler. Denosumab og risedronat, et bisphosphonat, evalueres for deres evne til at modvirke knogletab forbundet med AI-terapi.
denosumab Study20: et multicenter, randomiseret fase III-studie evaluerede brugen af denosumab 60 mg administreret subkutant en gang hver sjette måned hos postmenopausale kvinder, der tager AIs til HR+ ikke-metastatisk brystkræft. Målet var at vurdere ændringen i BMD i lændehvirvelsøjlen fra baseline til 12 måneder. Af de 252 patienter blev 127 tildelt denosumab og 125 tildelt placebo. Begge arme modtog calcium og vitamin D. BMD blev evalueret ved røntgenabsorptiometri med dobbelt energi. Efter 12 og 24 måneders behandling med denosumab eller placebo var der en forskel på henholdsvis 5,5% og 7,6% i BMD-stigning i lændehvirvelsøjlen til fordel for denosumab (P <.0001 for begge måneder). Denosumab viste en sammenlignelig toksicitetsprofil i forhold til placebo. Denosumab-behandling i mere end 24 måneder er endnu ikke blevet vurderet.
IBIS-II Bone Sub-Study21: International Breast Cancer Intervention Study-II (IBIS-II) Bone Sub-Study blev afledt af IBIS-II, som evaluerede postmenopausale kvinder med en øget sandsynlighed for at udvikle brystkræft, som blev randomiseret til anastrosol eller placebo i fem år. Understudiet, med en nuværende tilmelding på 700 patienter, evaluerer risedronat versus placebo til forebyggelse af BMD-tab hos kvinder med lave T-score ved baseline. En undergruppe af patienter fra IBIS-II-studiet blev tildelt en af tre forskellige behandlingsstrategier i delundersøgelsen. Efter et års behandling fik 350 patienter med ibis-II og 350 placebo resultater. Stratum 1 omfattede 227 patienter med normal T-score (T-score ?1), stratum 2 omfattede 80 patienter med osteopeni (kr2.5 ? T-score <1), som fik tildelt risedronat 35 mg en gang om ugen eller placebo, og stratum 3 omfattede 43 patienter med osteoporose (lars4 <2, 5), som fik tildelt risedronat 35 mg en gang om ugen.
for patienter med osteopeni eller osteoporose ved baseline syntes risedronat at hæmme knogletab forbundet med anastrosol. I stratum II viste risedronat gunstige virkninger på BMD-konservering for den samlede hofte, men ikke lændehvirvelsøjlen (P =.005 og P =.15 henholdsvis vs. placebo). Ingen alvorlige bivirkninger eller lægemiddelinteraktioner var forbundet med risedronat.
forsøg med AIs hos præmenopausale kvinder (Blød)21-26
cirka 33% af kvinder under 50 år vil blive diagnosticeret med invasiv brystkræft. 22 undertrykkelsen af Ovariefunktionsforsøg (SOFT, IBCSG 24-02, BIG 2-02) undersøger brugen af AI-terapi hos præmenopausale kvinder med HR+ brystkræft. Forsøget, der har en målrettet patientindskrivning på 3.000, involverer præmenopausale kvinder med HR+ brystkræft, der har afsluttet kemoterapi eller som kun har fået operation. Ovarieablation etableres ved administration af triptorelin (et gonadotropinfrigivende hormon) en gang om måneden i fem år, kirurgisk oophorektomi eller bækkenbestråling. Patienter vil blive randomiseret til en af tre arme, hvor den første arm modtager tamoksifen en gang dagligt i fem år, den anden arm modtager tamoksifen i fem år i kombination med ovarieablation, og den tredje arm modtager eksemestan i fem år i kombination med ovarieablation. Patienter vil modtage eksemestan eller tamoksifen i fem år.
Kemopræventionsforsøg23-27
Tamoksifen er indiceret til brystkræftkemoprævention.6 dets toksicitetsprofil er en årsag til begrænsning med hensyn til terapeutisk anvendelse.6 AIs kan reducere forekomsten af HR+ brystkræft hos højrisikopatienter på grund af et fald i forekomsten af CLBC sammenlignet med tamoksifen i kliniske forsøg som atac.6
AI-kemopræventionsundersøgelser inkluderer International Breast Cancer Study Group (IBCSG) trial 31-03 (IBCSG 31-03) og National Cancer Institute of Canadas kort.3 forsøg. Det primære mål med multicenter, international, randomiseret, placebokontrolleret IBCSG 31-03 forsøg er at evaluere brugen af anastrosol til forebyggelse af brystkræft hos postmenopausale kvinder. Dens primære resultatmål er forekomsten af invasiv og ikke-invasiv brystkræft; det sekundære resultatmål er forekomsten af osteoporose og brud.5 IBCSG 31-03-forsøget har en måltilmelding på 6.000. kortlægning.3 forsøg evaluerer eksemestan som et kemopreventivt middel hos postmenopausale kvinder. Det primære mål for det placebokontrollerede MAP.3 forsøg er at vurdere effektiviteten af eksemestan til at mindske forekomsten af invasiv brystkræft.
potentielle fremtidige anvendelser: Sagsrapporter
Letrosol blev brugt efter svigt af clomiphen til at inducere fertilitet hos 22 kvinder med polycystisk ovariesyndrom. I 75% af cyklusser versus 44,4% af cyklusser induceret af clomiphen. Fire graviditeter skyldtes ægløsning induceret af letrosol, og ingen signifikante bivirkninger var forbundet med letrosol.28,29
en 57-årig overvægtig kvinde med endometriose efter hysterektomi og bilateral salpingo-ooforektomi modtog anastrosol efter megestrolbehandling. Patienten havde ingen endometriale læsioner efter ni måneder.28,30
en patient med McCune-Albrights syndrom fik anastrosol til for tidlig pubertet; patientens østradiol normaliseret efter 2,5 års anastrosol og knoglealderen Fremskreden med seks måneder.28,31 øget østrogen kan inducere gynækomasti og hypogonadotropisk hypogonadisme.28,31 faldende østrogen med en AI resulterede i normal gonadotropin og testosteron hos mænd med gynækomasti og hypogonadotropisk hypogonadisme. 28,31,32
28,33 Neoadjuvant letrosol blev givet til 10 postmenopausale kvinder med endometriecancer; lægemidlet viste konstruktive kliniske ændringer og havde ingen negativ kirurgisk virkning.28,34
når behandling med testolacton versus anastrosol blev sammenlignet hos infertile mænd, var effekten af de to midler ens.28,35 patienter med Klinefelters syndrom havde mere effektiv behandling med testolacton end med anastrosol.28,35
konklusioner
tredje generation AIs har vist overlegen DFS hos postmenopausale kvinder med HR+ brystkræft, men den kliniske fordel ved mere end fem års AI-behandling hos disse patienter er ikke fastlagt.4 Det Nationale kirurgiske adjuvans bryst – og Tarmprojekt (NSABP) B-33 (eksemestan) forsøg og en efterfølgende randomisering af MA.17 forsøg vil undersøge brugen af disse AIs versus placebo i yderligere fem år.4 AIs er et passende alternativ til HR+ postmenopausale kvinder, hvor tamoksifen er kontraindiceret.4
de gavnlige virkninger af tredje generation AIs inkluderer en mere tolerabel toksicitetsprofil og overlegen DFS sammenlignet med tamoksifen. Virkningen mellem disse lægemidler og tamoksifen er sammenlignelig. Der er fortsat usikkerhed om den valgte behandlingsvarighed, den langsigtede toksicitetsprofil og den passende administrationssekvens for AIs.4 nye undersøgelser er nødvendige for at producere selektive aromatasemodulatorer, der vil producere mindre toksicitet end AIs.25,36 – 37
1. Robertson JFR. Fulvestrant-hvordan man laver et godt stof bedre. Onkolog . 2007;12:774-784.
2. Osborne CK. Lægemiddelterapi: tamoksifen i behandlingen af brystkræft. N Engl J Med. 1998;339:1609-1618.
3. Nationalt Kræft Omfattende Netværk. NCCN retningslinjer for klinisk praksis inden for onkologi-v. 1. 2008. Brystkræft. www.nccn.org/professionals/physician_gls/f_guidelines.asp. adgang til 11. oktober 2007.
4. Vin EP, Hudis C, Burstein HJ, et al. American Society of Clinical Oncology technology assessment om brugen af aromatasehæmmere som adjuverende terapi til postmenopausale kvinder med hormonreceptorpositiv brystkræft: statusrapport 2004. J Clin Oncol . 2005;23:619-629.
5. Dl, Ford LG. Forebyggelse af hormonrelaterede kræftformer: brystkræft. J Clin Oncol. 2005;23:357-367.
6. Smith dvs.aromatasehæmmere i brystkræft. N Engl J Med. 2003;348:2431-2442.
7. Goss PE, Strasser K. Aromatasehæmmere til behandling og forebyggelse af brystkræft. J Clin Oncol . 2001;19:881-894.
8. Lacy CF, Armstrong LL, Goldman MP, et al, eds. Drug Information Håndbog. 13. udgave. Hudson, OH: leksikon-Comp; 2005: 117,598,871.
9. Ellis MJ, Red. Aromatasehæmmere til behandling af brystkræft. Manhasset, NY: Oncology Publishing Group, CMP Healthcare Media; 2005: 29-45.
10. Indlægsseddel. Wilmington, DE: AstraZeneca Lægemidler LP, Maj 2007.
11. Arora A, Potter JF. Aromatase inhibitors: current indications and future prospects for treatment of postmenopausal breast cancer. J Am Geriatr Soc. 2004;52:611-616.
12. Femara (letrozole) package insert. East Hanover, NJ: Novartis Pharmaceuticals Corp; December 2006.
13. Shaw G. In preventing breast cancer occurrence…anastrozole beats tamoxifen in ATAC. Clin Oncol News . 1/2008. www.clinicaloncology.com/index.asp?ses=ogst§ion_id=148&Vis=dept& article_id=9884. Adgang Til 17. Marts 2008.
14. Aromasin (eksemestan) indlægsseddel. København, Danmark: Denmark; Februar 2007.
15. For Atac Trialists’ Group. Til adjuverende behandling af postmenopausale kvinder med tidlig brystkræft: første resultater af det randomiserede ATAC-forsøg. Lancet. 2002;359:2131-2139.
16. For Atac Trialists’ gruppe. Alene eller i kombination) efter afslutning af 5 års adjuverende behandling for brystkræft. Lancet. 2005;365:60-62.
17. Goss PE, Ingle JN, Martino s, et al. Et randomiseret forsøg med letrosol hos postmenopausale kvinder efter fem års behandling med tamoksifen mod brystkræft i det tidlige stadium. N Engl J Med. 2003;349:1793-1802.
18. Thrlimann B, Keshaviah a, Coates AS, et al, for Breast International Group (BIG) 1-98 Collaborative Group. Hos postmenopausale kvinder med tidlig brystkræft. N Engl J Med. 2005;353:2747-2757.
19. Coombes RC, Hall E, Gibson LJ, Et al, til den Intergruppe Eksemestane undersøgelse. Et randomiseret forsøg med eksemestan efter to til tre års behandling med tamoksifen hos postmenopausale kvinder med primær brystkræft. N Engl J Med. 2004; 350:
1081-1092.
20. Ellis G, knogle HG, Chlebovski R, et al. En fase 3-undersøgelse af effekten af denosumab-behandling på knoglemineraltæthed hos kvinder, der får aromatasehæmmere for ikke-metastatisk brystkræft. Papir præsenteret på: det 30. årlige San Antonio Breast Cancer Symposium; 13. -16. December 2007; San Antonio. Abstrakt 47.
21. Singh S, Cusick J, Edvard R, et al. Effekt af knoglemineraltæthed efter et års behandling: Resultater fra bone sub-study af International Breast Cancer Intervention Study (IBIS-II). Papir præsenteret på: det 30. årlige San Antonio Breast Cancer Symposium; 13. -16. December 2007; San Antonio. Abstrakt 28.
22. Dellapaska S, Colleoni M, Gelber RD, Goldhirsch A. adjuverende endokrin terapi til præmenopausale kvinder med tidlig brystkræft. J Clin Oncol. 2005;23:1736-1750.
23. National Cancer Institute. Behandling af brystkræft (PDK). www.cancer.gov/cancertopics/pdq/treatment/breast/healthprofessional. adgang til 26. December 2007.
24. Baylor College of Medicine kliniske forsøg. Undertrykkelse af Ovariefunktionsforsøg (blød). www.breastcenter.tmc.edu/clinic/trials/soft.htm. adgang til 26. December 2007.
25. Aebi S, Castiglione-Gertsch M. adjuverende endokrin terapi til de meget unge patienter. Bryst. 2003;12:509-515.
26. ClinicalTrials.gov. undertrykkelse af ovariefunktion plus enten tamoksifen eller eksemestan sammenlignet med tamoksifen alene til behandling af præmenopausale kvinder med hormonresponsiv brystkræft. www.clinicaltrials.gov/. adgang til 26. December 2007.
27. Cusick J. Aromatasehæmmere til forebyggelse af brystkræft. J Clin Oncol. 2005;23:1636-1643.
28. Karaer O, Oru K. S., Koyuncu FM. Aromatasehæmmere: mulige fremtidige anvendelser. Acta Obstet Gynecol Scand. 2004:83:699-706.
29. MF, Casper RF. Anvendelse af en aromatasehæmmer til induktion af ægløsning hos patienter med utilstrækkelig respons på clomifencitrat. Fertil Steril. 2001;75:305-309.
30. Bulun SE, Yang S, Fang Å, et al. Aromatases rolle i endometrial sygdom. J Steroid Biochem Mol Biol. 2001;79:19-25.
31. Feuillan P, Merke D, Leschek y, Cutler GB. Anvendelse af aromatasehæmmere i tidlig pubertet. Endocr Relaterer Kræft. 1999;6:303-306.
32. M, Sebastian S, Takayama K, et al. Østrogenoverskud forbundet med nye gain-of-function mutationer, der påvirker aromatase genet. N Engl J Med. 2003;348:1855-1865.
33. A, Gabra H, Langdon SP, et al. CA 125-respons er forbundet med østrogenreceptorekspression i et fase II-forsøg med letrosol i ovariecancer: identifikation af en endokrin-følsom undergruppe. Clin Kræft Res. 2002; 8: 2233-2239.
34. Berstein L, Maksov S, Gershfeld E, et al. Behandling af endometriecancer med aromatasehæmmeren letrosol: endokrine og kliniske virkninger. Eur J Obstet Gynecol Reprod Biol. 2002;105:161-165.
35. Raman JD, Schlegel PN. Aromatasehæmmere til mandlig infertilitet. J Urol. 2002;167:624-629.
36. Aromatase og dets hæmmere: betydning for brystkræftbehandling. Seneste Prog Horm Res. 2002; 57:317-338.