fűtési görbék
ábra \(\PageIndex{3}\) egy 75 g-os vízmintára vonatkozó melegítési görbét, a hőmérséklet és a melegítési idő viszonyát mutatja. A minta kezdetben jég 1 atm-en és -23 CC-on; hő hozzáadásával a jég hőmérséklete az idő múlásával lineárisan növekszik. A vonal meredeksége mind a jég tömegétől, mind a jég fajlagos hőjétől (Cs) függ, amely az 1 g jég hőmérsékletének 1 CC-vel történő emeléséhez szükséges Joule-ok száma. Ahogy a jég hőmérséklete emelkedik, a jégkristályban lévő vízmolekulák egyre több energiát vesznek fel, és erőteljesebben rezegnek. Az olvadáspontnál elegendő mozgási energiával rendelkeznek ahhoz, hogy legyőzzék a vonzó erőket és egymáshoz képest mozogjanak. Mivel több hőt adunk hozzá, a rendszer hőmérséklete nem növekszik tovább, hanem állandó marad 0 cc-nál, amíg az összes jég el nem olvad. Miután az összes jeget folyékony vízzé alakították át, a víz hőmérséklete ismét emelkedni kezd. Most azonban a hőmérséklet lassabban növekszik, mint korábban, mert a víz fajlagos hőkapacitása nagyobb, mint a jégé. Amikor a víz hőmérséklete eléri a 100 cc-ot, a víz forrni kezd. Itt is a hőmérséklet állandó marad 100 cc-nál, amíg az összes vizet gőzzé nem alakítják. Ezen a ponton a hőmérséklet ismét emelkedni kezd, de gyorsabban, mint a többi fázisban, mert a gőz hőkapacitása kisebb, mint a jég vagy a vízé.
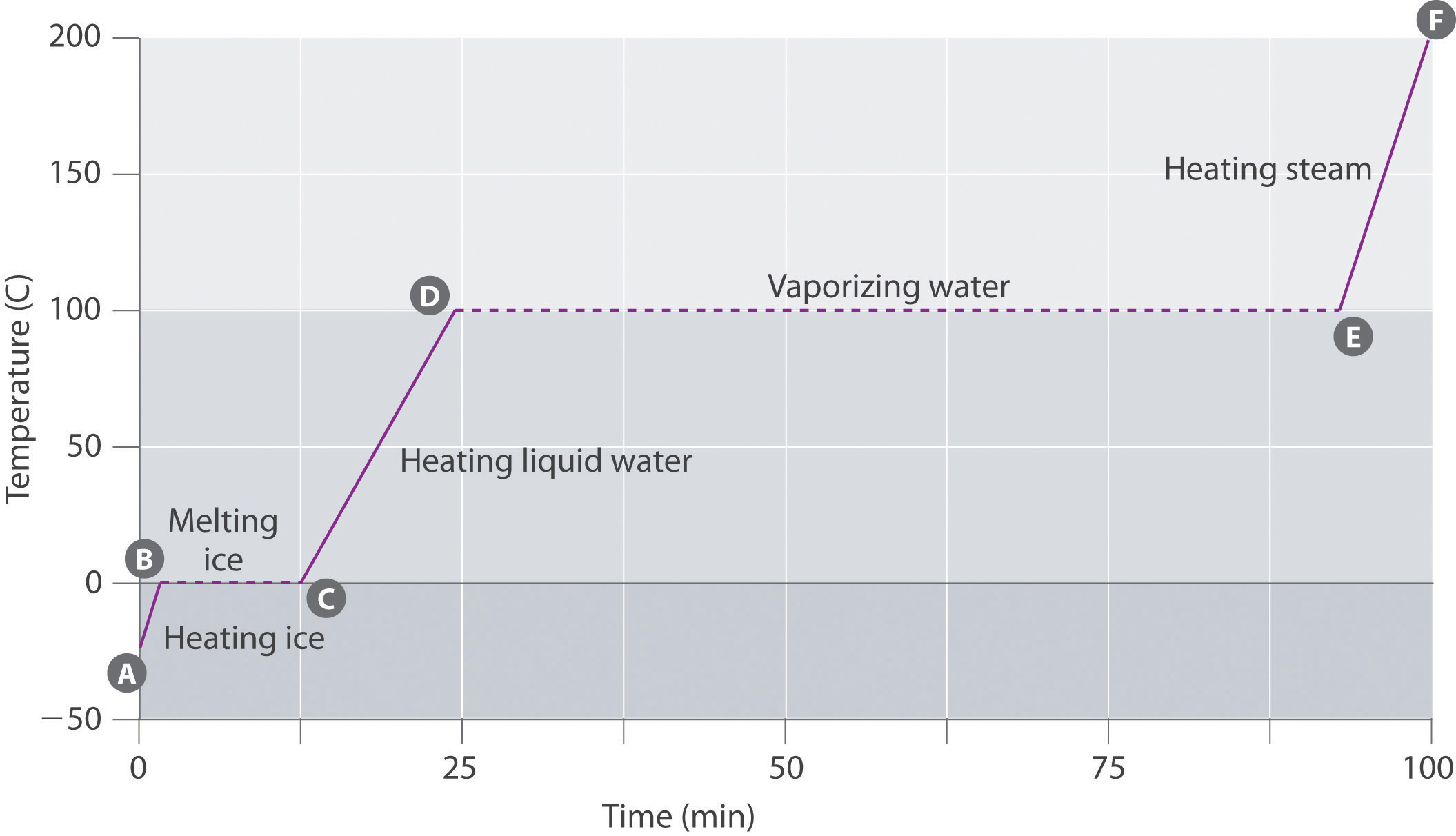
így a rendszer hőmérséklete nem változik a fázisváltás során. Ebben a példában, amíg még egy kis mennyiségű jég is jelen van, a rendszer hőmérséklete az olvasztási folyamat során 0 CC-on marad, és amíg még kis mennyiségű folyékony víz is jelen van, a rendszer hőmérséklete 100 cc-on marad a forrási folyamat során. A hő hozzáadásának sebessége nem befolyásolja a jég/víz vagy víz/gőz keverék hőmérsékletét, mivel a hozzáadott hőt kizárólag a kondenzáltabb fázist összetartó vonzó erők leküzdésére használják. Sok szakács úgy gondolja, hogy az étel gyorsabban szakács, ha a hőt magasabbra fordítják, így a víz gyorsabban forr. Ehelyett a fazék víz hamarabb szárazra forr, de a víz hőmérséklete nem függ attól, hogy milyen erőteljesen forr.
a minta hőmérséklete nem változik a fázisváltás során.
Ha a hőt állandó sebességgel adják hozzá, mint a \(\PageIndex{3}\) ábrán, akkor a vízszintes vonalak hossza, amely azt az időt jelenti, amely alatt a hőmérséklet nem változik, egyenesen arányos a fázisváltozásokhoz kapcsolódó entalpiák nagyságával. A \(\PageIndex{3}\) ábrán a vízszintes vonal 100 C-nál sokkal hosszabb, mint a 0 C-nál, mert a víz elpárologtatásának entalpiája többszörösen nagyobb, mint a fúzió entalpiája.
a túlhevített folyadék egy folyadék mintája azon a hőmérsékleten és nyomáson, amelyen gáznak kell lennie. A túlhevített folyadékok nem stabilak, a folyadék végül forrni fog, néha hevesen. A túlhevülés jelensége “ütközést” okoz, amikor folyadékot melegítenek a laboratóriumban. Ha például egy vizet tartalmazó kémcsövet melegítenek egy Bunsen-égőn, akkor a folyadék egy része könnyen túl forró lehet. Amikor a túlhevített folyadék gázzá alakul, a folyadék többi részét kiszoríthatja vagy “kidughatja” a kémcsőből. Keverőrúd vagy egy kis darab kerámia (“forrásban lévő chip”) elhelyezése a kémcsőben lehetővé teszi, hogy gőzbuborékok képződjenek a tárgy felületén, így a folyadék forr, ahelyett, hogy túlhevülne. A túlhevítés az oka annak, hogy a mikrohullámú sütőben sima csészében melegített folyadék nem forrhat fel, amíg a csésze meg nem mozdul, amikor a csésze mozgása lehetővé teszi a buborékok kialakulását.