a Redox reakciók az elektronok egyik anyagból a másikba történő átviteléről szólnak, ezért hasznos, ha van egy rendszer, amely nyomon követi, hogy mi nyer és mi veszít elektronokat, és hány elektron vesz részt. A redox reakciók nyilvántartási rendszerét oxidációs számoknak nevezzük. Emlékezhet arra is, amit elektronegativitásnak hívnak a korábbi kémiai órákból.
Elektronegativitás
a kötött atom azon képessége, hogy magához vonzza a megosztott elektronokat.
amikor két különböző elemű atomot kovalens kötés köt össze (megosztó elektronok), az elektronok általában nem oszlanak meg egyenlően a két atom között az elektronegativitásuk különbségei miatt. Gondolj erre úgy, mint egy kötélhúzásra az elektronok számára. Néha mindkét Atom azonos erővel húzza a megosztott elektronokat; máskor egyértelműen van egy erősebb játékos, aki közelebb húzza az elektronokat önmagához.
Tekintsük a kötést egy hidrogénatom (egy vegyértékelektronnal) és egy oxigénatom (annak hat vegyértékelektronjával)között:
|
|
+
|
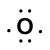 |
=
|
 |
Because oxygen has a higher electronegativity than hydrogen, the shared electrons are closer to the oxygen atom than to a hidrogénatom. Ez nem az elektronok teljes átadása, amely iont hozna létre, de részleges töltések alakulnak ki. A kötés hidrogénvége részben pozitív (+1) , mert részben elvesztett egy elektront, a H–O oxigén vége pedig részben negatív (-1), mert részben megszerezte az egy elektront hidrogénből:
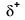 |
|
 |
|
Our molecule is incomplete, however, because there is a lone electron around oxygen. Let’s add one more hydrogen to complete our water molecule:
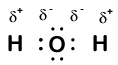
látjuk, hogy a két hidrogén mindegyike” elvesztett ” egy elektront az oxigénnel szemben. Az oxigén két elektront “nyert” – egyet minden hidrogénből. Ismét ezek nem igaz ionok, de hasznos ugyanúgy gondolni rájuk.
a molekula atomjainak ilyen módon adott töltéseit oxidációs számoknak nevezzük. Az oxidációs számok segítségével nyomon követhetjük, hogy hol vannak az elektronok egy molekulában, és hogyan mozognak a reakció során. Vízpéldánkban a hidrogénhez + 1 oxidációs számot rendelünk, mert minden egyes hidrogén “elvesztett” egy elektront. Az oxigén oxidációs száma +2, mert az egyetlen oxigénatom összesen két elektront “nyert”, mindegyik hidrogénből egyet.
itt van egy másik molekula, amely hidrogént és oxigént tartalmaz—hidrogén-peroxid, H2O2:
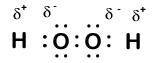
a hidrogén-peroxidban minden hidrogén oxidációs száma még mindig +1, mert minden hidrogén egyetlen elektront “ad fel” az oxigénnek. Az oxigén oxidációs száma azonban -1, mivel minden oxigén csak egy elektront nyer a szomszédos hidrogénből. A két azonos oxigénatom közötti elektronok egyenlően oszlanak meg, tehát ebből a kötésből nem származik részleges töltés.
oxidációs szám
egy molekula vagy ion atomjához rendelt pozitív vagy negatív szám, amely az elektronok részleges nyereségét vagy veszteségét tükrözi.
a molekula egyes elemeinek oxidációs számának ismerete kulcsfontosságú lépés lesz a redox reakciók megértésében. Szerencsére ez általában nem jár rajz electron dot diagramok. Ehelyett van egy sor szabály, amelyet felhasználhatunk az oxidációs számok meghatározására. Itt vannak a fő szabályok:
| egy tiszta elem oxidációs száma (önmagában, nem ion) nulla. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
The oxidation number of a monatomic ion (by itself or as part of an ionic compound) is equal a terhére. az alkálifémek—a periódusos rendszer első oszlopának elemei-oxidációs száma mindig + 1; az alkáliföldfémek (2.oszlop) szinte mindig +2. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The oxidation number of hydrogen is almost always +1 when it is in a compound. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
az oxigén oxidációs száma szinte mindig -2, ha egy vegyületben van. kivételek:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
a vegyület oxidációs számainak összege nulla. az mn oxidációs számának meghatározásához az Mn2O7-ben visszafelé kell dolgoznunk:
-2 xhamster 7 Atom = -14 összesen mivel az oxidációs számok összegének nullának kell lennie, az mn teljes oxidációs számának +14-nek kell lennie az oxigén -14 kiürítéséhez, de mivel 2 Mn atom van, minden egyes atom oxidációs száma +7 lesz:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
az oxidációs számok összege egy többatomos ionban megegyezik az adott ion töltésével. ismét dolgozzon visszafelé bármely nem oxigén vagy nem hidrogénatom oxidációs számának meghatározásához. a Cr oxidációs számának meghatározása a Cr2O72 – ben -:
-2 ++ 7 = -14
+12 + (-14) = -2
= +7
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
It is fontos megjegyezni, hogy az oxidációs szám mindig a vegyület minden egyes atomjára vonatkozik, nem pedig az adott elem összességére.
például H2O – ban mindkét hidrogénatom teljes pozitív “töltése” +2 lesz (amely egyensúlyban van az oxigén -2-vel), de minden hidrogén oxidációs száma +1.
Contributions & Attributions
Ez az oldal a következő közreműködő (k) által létrehozott tartalomból készült, és a LibreTexts fejlesztői csapata szerkesztette (helyileg vagy kiterjedten), hogy megfeleljen a platform stílusának, bemutatásának és minőségének:CK-12 Alapítvány: Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson és Jean Dupon.