tanulási célok
- használja a sejtjelölést a galvanikus cellák leírására
- írja le a galvanikus cellák alapvető összetevőit\
galvanikus cellák, más néven voltaic cellák, olyan elektrokémiai cellák, amelyekben a spontán oxidációs-redukciós reakciók elektromos energiát termelnek. Az egyenletek írásakor gyakran célszerű az oxidációs-redukciós reakciókat félreakciókra szétválasztani, hogy megkönnyítsék az általános egyenlet kiegyensúlyozását és hangsúlyozzák a tényleges kémiai átalakulásokat.
fontolja meg, mi történik, ha egy tiszta rézfémdarabot ezüst-nitrát oldatba helyeznek (\(\PageIndex{1}\) ábra). Amint a rézfém hozzáadódik, ezüst Fém kezd kialakulni, és rézionok jutnak az oldatba. A jobb szélen lévő oldat kék színe rézionok jelenlétét jelzi. A reakció két félreakcióra osztható. A félreakciók elválasztják az oxidációt a redukciótól, így mindegyiket külön-külön lehet figyelembe venni.
a redukciós félreakció egyenletét meg kellett duplázni, így a redukciós félreakcióban “megszerzett” elektronok száma megegyezett az oxidációs félreakcióban “Elveszett” elektronok számával.

a galvanikus vagy voltaic cellák spontán elektrokémiai reakciókat tartalmaznak, amelyekben a félreakciókat elválasztják (\(\PageIndex{2}\) Ábra), hogy az áram egy külső vezetéken keresztül áramolhasson. Az ábra bal oldalán található főzőpoharat félcellának nevezzük, amely 1 M-es réz(II) – nitrát oldatot tartalmaz, részben az oldatba merített rézfémdarabbal. A rézfém elektróda. A réz oxidáción megy keresztül; ezért a rézelektród az anód. Az anód vezetékkel van összekötve egy voltmérővel, a voltmérő másik kivezetése pedig egy vezetékkel van összekötve egy ezüst elektródával. Az ezüst redukció alatt áll; ezért az ezüst elektróda a katód. Az ábra jobb oldalán található félcella az ezüst elektródából áll, 1 M-es ezüst-nitrát-oldatban (AgNO3). Ezen a ponton nincs áram—vagyis az elektronok jelentős mozgása a vezetéken keresztül nem következik be, mert az áramkör nyitva van. Az áramkört egy sóhíd segítségével zárják le, amely mozgó ionokkal továbbítja az áramot. A sóhíd koncentrált, nem reaktív elektrolitoldatból, például a példában használt nátrium-nitrát (NaNO3) oldatból áll. Amint az elektronok balról jobbra áramlanak az elektródon és a huzalon keresztül, a nitrátionok (anionok) áthaladnak a bal oldali porózus dugón a réz(II) – nitrát oldatba. Ez a bal oldali főzőpoharat elektromosan semlegesnek tartja azáltal, hogy semlegesíti a réz(II) ionok töltését, amelyek az oldatban keletkeznek, amikor a rézfém oxidálódik. Ugyanakkor a nitrátionok balra mozognak, a nátriumionok (kationok) jobbra mozognak, a porózus dugón keresztül, a jobb oldalon lévő ezüst-nitrát oldatba. Ezek a hozzáadott kationok” helyettesítik ” az ezüstionokat, amelyeket eltávolítanak az oldatból, amikor ezüstfémre redukálódnak, a főzőpoharat a jobb oldalon tartva elektromosan semleges. A sóhíd nélkül a rekeszek nem maradnának elektromosan semlegesek, és nem folyna jelentős áram. Ha azonban a két rekesz közvetlenül érintkezik, akkor nincs szükség sóhídra. Amint az áramkör befejeződik, a voltmérő +0,46 V értéket mutat, ezt cellapotenciálnak nevezzük. A sejtpotenciál akkor jön létre, amikor a két különböző fém összekapcsolódik, és az oxidációs-redukciós reakcióból származó egységnyi töltésenkénti energia mértéke. A volt az elektromos potenciál származtatott SI egysége
\
ebben az egyenletben A az áram amperben, C pedig a töltés coulombokban. Vegye figyelembe, hogy a voltokat meg kell szorozni a coulombs (C) töltésével, hogy megkapjuk az energiát Joule (J) – ben.
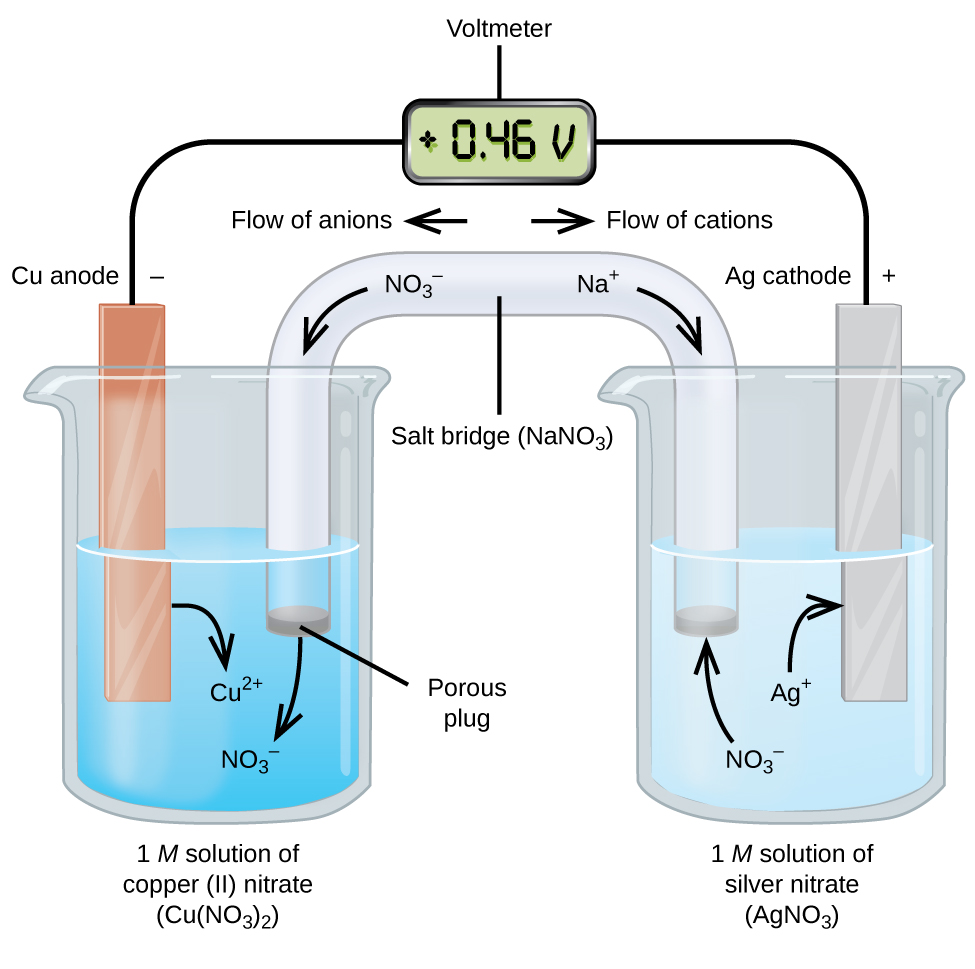
amikor az elektrokémiai cellát ilyen módon építjük fel, a pozitív sejtpotenciál spontán reakciót jelez, és hogy az elektronok balról jobbra áramlanak. Sok minden történik a \(\PageIndex{2}\) ábrán, ezért hasznos összefoglalni a rendszer dolgait:
- elektronok áramlanak az anódtól a katódig: balról jobbra az ábrán látható standard galvanikus cellában.
- a bal félcellában lévő elektróda az anód, mert itt oxidáció következik be. A név az anionok áramlására utal a sóhíd felé.
- A jobb félcellában lévő elektróda a katód, mert itt redukció történik. A név a kationok áramlására utal a sóhíd felé.
- az oxidáció az anódnál történik (az ábra bal oldali félcellája).
- a redukció a katódnál történik (az ábrán a jobb félcella).
- a sejtpotenciál, +0,46 V, ebben az esetben a két félsejt előállításához felhasznált anyagok természetében rejlő különbségekből származik.
- a sóhídnak jelen kell lennie, hogy lezárja (befejezze) az áramkört, és mind oxidációnak, mind redukciónak meg kell történnie az áram áramlásához.
sok lehetséges galvanikus sejt létezik, ezért általában rövidített jelölést használnak ezek leírására. A sejtjelölés (néha sejtdiagramnak nevezik) információt nyújt a reakcióban részt vevő különféle fajokról. Ez a jelölés más típusú cellákra is működik. A függőleges vonal, a++, fázishatárt, a kettős vonal pedig a sóhídot jelöli. Az anódra vonatkozó információkat balra írják, majd az anódoldatot, majd a sóhídot (ha jelen van), majd a katódoldatot, végül a jobb oldali katódra vonatkozó információkat. A \(\PageIndex{2}\) ábrán látható galvanikus cella jelölése ekkor
\
megjegyezzük, hogy a nézőionok nincsenek benne, és hogy minden félreakció legegyszerűbb formáját használtuk. Ha ismert, a különböző ionok kezdeti koncentrációit általában tartalmazza.
az egyik legegyszerűbb sejt a Daniell-sejt. Ezt az akkumulátort úgy lehet megépíteni, hogy egy rézelektródot helyezünk egy üveg aljára, és a fémet réz-szulfát oldattal fedjük le. A réz-szulfát-oldat tetején cink-szulfát-oldatot lebegtetünk; majd egy cinkelektródot helyezünk a cink-szulfát-oldatba. A rézelektród csatlakoztatása a cinkelektródhoz lehetővé teszi az elektromos áram áramlását. Ez egy példa egy sóhíd nélküli sejtre, ahol ionok áramolhatnak át a két oldat közötti interfészen.
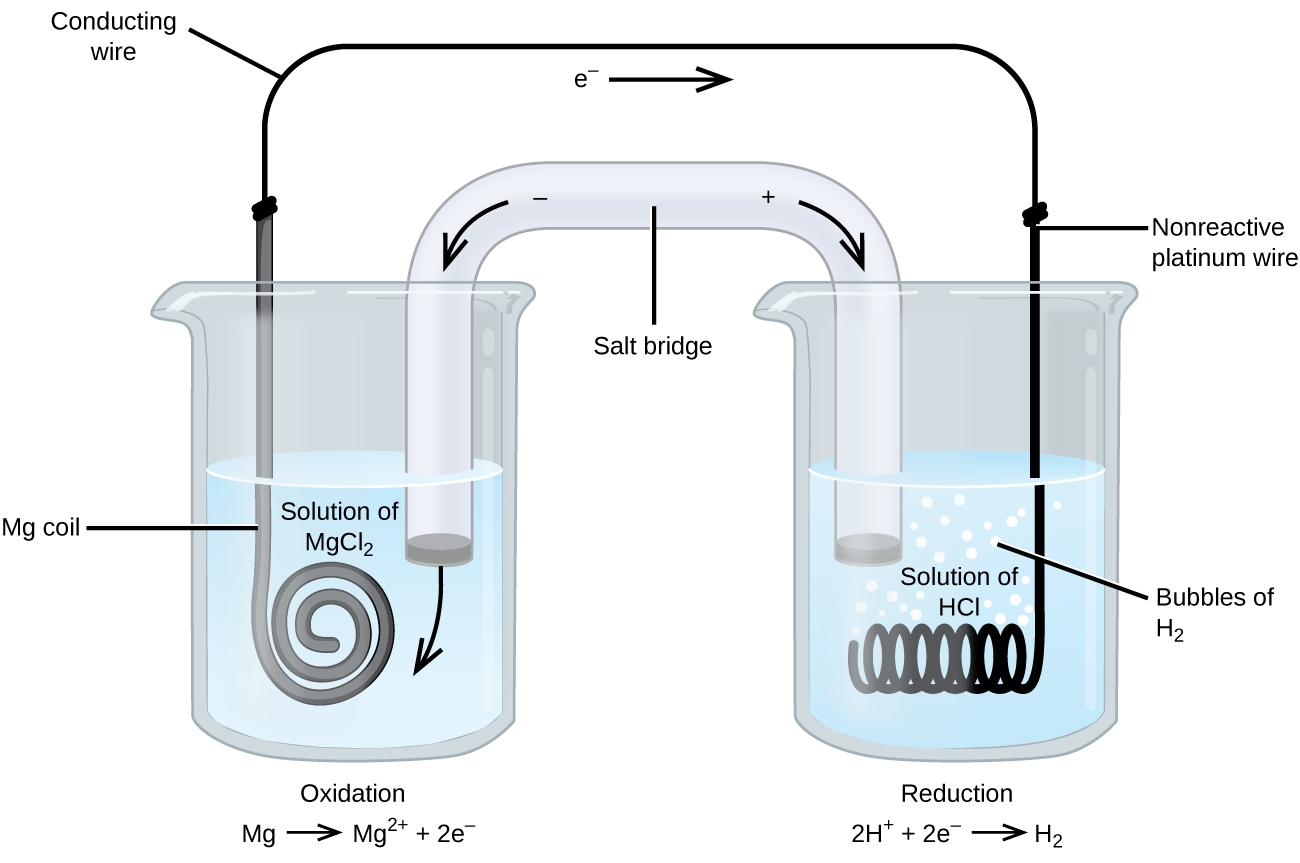
egyes oxidációs-redukciós reakciók olyan fajokat érintenek, amelyek rossz elektromos vezetők, ezért olyan elektródot használnak, amely nem vesz részt a reakciókban. Gyakran az elektróda platina, arany vagy grafit, amelyek mindegyike inert sok kémiai reakcióhoz. Az egyik ilyen rendszer a \(\PageIndex{3}\) ábrán látható. A magnézium az ábrán bal oldali anódnál oxidálódik, a hidrogénionok pedig a jobb oldali katódnál redukción mennek keresztül. A reakció összefoglalható
a cella inert platinahuzal a katódhoz, tehát a cella jelölése
a magnézium elektróda aktív elektróda, mert részt vesz az oxidációs-redukciós reakcióban. Az Inert elektródák, mint például a \(\PageIndex{3} \ ábrán látható platina elektróda, nem vesznek részt az oxidációs-redukciós reakcióban, és jelen vannak, így az áram átfolyhat a cellán. A platina vagy az arany általában jó inert elektródákat készít, mert kémiailag nem reagálnak.
példa \(\PageIndex{1}\): cella jelölés használata
Vegyünk egy galvanikus cellát, amely
\
írja le az oxidációs és redukciós félreakciókat, és írja le a reakciót a cella jelöléssel. Milyen reakció lép fel az anódnál? A katód?
megoldás
ellenőrzéssel a Cr oxidálódik, amikor három elektron elveszik a Cr3+ képződéséhez, és a Cu2+ csökken, mivel két elektront nyer, hogy Cu-t képezzen. A töltés kiegyensúlyozása a
\
cella jelölését az egyes egyenletek legegyszerűbb formájára használja, és az anódon történő reakcióval kezdődik. Koncentrációkat nem határoztak meg, így:
\
oxidáció az anódnál, redukció a katódnál történik.
példa \(\PageIndex{2}\): cella jelölés használata
Vegyünk egy galvanikus cellát, amely
írja le az oxidációs és redukciós félreakciókat, és írja le a reakciót cella jelöléssel. Milyen reakció lép fel az anódnál? A katód?
oldat
ellenőrzéssel a Fe2+ oxidáción megy keresztül, amikor egy elektron elveszik, hogy Fe3+− t képezzen, az MnO4 pedig csökken, mivel öt elektront nyer, hogy Mn2+ – t képezzen. A töltés kiegyensúlyozása a
\
cella jelölését az egyes egyenletek legegyszerűbb formájára használja, és az anódon történő reakcióval kezdődik. Inert elektródot, például platinát kell használni, mert nincs jelen fém az elektronok anódtól a katódig történő vezetéséhez. Koncentrációkat nem határoztak meg, így:
\
oxidáció az anódnál, redukció a katódnál történik.
Exercise \(\PageIndex{1}\)
cella jelöléssel írja le azt a galvanikus cellát, ahol a réz(II) ionok rézfémre redukálódnak, a cink fém pedig cinkionokká oxidálódik.
válasz
a problémában megadott információk alapján:
\
cellajelölés használata:
\
összefoglaló
az elektrokémiai cellák általában két félcellából állnak. A félcellák elválasztják az oxidációs félreakciót a redukciós félreakciótól, és lehetővé teszik az áram áramlását egy külső vezetéken keresztül. Az egyik félcella, amelyet általában a bal oldalon ábrázolnak egy ábrán, tartalmazza az anódot. Az oxidáció az anódon történik. Az anód a másik félcellában lévő katódhoz van csatlakoztatva, gyakran a jobb oldalon látható egy ábrán. A redukció a katódnál történik. Sóhíd hozzáadása befejezi az áramkört, amely lehetővé teszi az áram áramlását. A sóhíd anionjai az anód felé, a sóhíd kationjai pedig a katód felé áramlanak. Ezeknek az ionoknak a mozgása kiegészíti az áramkört, és minden félcellát elektromosan semlegesnek tart. Az elektrokémiai cellákat cellanevezéssel lehet leírni. Ebben a jelölésben a bal oldalon az anód reakciójára vonatkozó információk, a jobb oldalon a katód reakciójára vonatkozó információk jelennek meg. A sóhídot kettős vonal képviseli, amely a). A félcellán belüli szilárd, folyékony vagy vizes fázisokat egyetlen vonal választja el egymástól, a cetlin. A különböző fajok fázisa és koncentrációja a faj neve után szerepel. Az oxidációs-redukciós reakcióban részt vevő elektródákat aktív elektródáknak nevezzük. Azok az elektródák, amelyek nem vesznek részt az oxidációs-redukciós reakcióban, de lehetővé teszik az áram áramlását, inert elektródák. Az Inert elektródákat gyakran platinából vagy aranyból készítik, amelyeket sok kémiai reakció nem változtat.
szószedet
aktív elektróda elektróda, amely részt vesz egy elektrokémiai cella oxidációs-redukciós reakciójában; az aktív elektróda tömege megváltozik az oxidációs-redukciós reakció során anód elektróda egy elektrokémiai cellában, amelynél oxidáció következik be; az anódra vonatkozó információkat a sóhíd bal oldalán rögzítik a sejtjelölés katódelektródájában egy elektrokémiai cellában, amelynél redukció történik; a katódra vonatkozó információkat a sóhíd jobb oldalán rögzítik a sejtjelölés cell notation rövidítés módja annak, hogy ábrázolják a reakciókat egy elektrokémiai cellában sejtpotenciál különbség az elektromos potenciálban, amely akkor merül fel, amikor különböző fémek vannak csatlakoztatva; az oxidációs redukciós reakciókban a töltés (áram) áramlásának hajtóereje galvanikus cella elektrokémiai cella, amely spontán oxidációs-redukciós reakciót foglal magában; pozitív sejtpotenciálú elektrokémiai cellák; más néven voltaikus cella inert elektróda elektróda, amely lehetővé teszi az áram áramlását, de egyébként nem vesz részt az elektrokémiai cellában az oxidációs-redukciós reakcióban; az inert elektróda tömege nem változik az oxidációs-redukciós reakció során; az inert elektródák gyakran platinából vagy aranyból készülnek, mert ezek a fémek kémiailag nem reagálnak. voltaic cella egy másik neve a galvanikus cella
közreműködők és attribútumok
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) és Richard Langley (Stephen F. Austin State University) közreműködő szerzők. Az OpenStax College által készített tankönyv-tartalom Creative Commons Attribution License 4.0 licenc alatt engedélyezett. Töltse le ingyen a http://cnx.org/contents/85abf193-2bd…[email protected]ímen).