a Delokalizáció akkor történik, ha az elektromos töltés több atomra oszlik. Például a kötő elektronok eloszthatók több egymással összekapcsolt atom között.

1.példa:
az egyik legismertebb példa egy olyan molekulára, amelyben a kötő elektronok delokalizálódnak, a benzol, az alábbiakban látható:
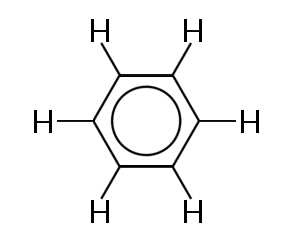
a benzol hat szénatomból álló gyűrűből áll. A szénatomok mind sp2 hibridizálva egy nem hibridizált p pályával.
az sp2 hibrid pályái normál kovalens kötéseket hoznak létre, amelyeket néha úgy is neveznek: ezek az egyetlen C-C kötések és az egyetlen C-H kötések.
Ez minden szénatomot elektronokkal hagy a p orbitális derékszögben a gyűrű síkjához.
az alábbi ábrán a bal oldalon láthatja az SP2 pályákat, amelyek kovalens kötéseket alkotnak. A jobb oldalon láthatja a p pályákat, amelyek mindegyike tartalmaz egy elektronot.
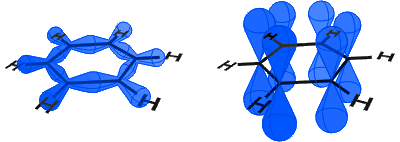
A p pályákat oldalirányban egyesítik, a p pályákon lévő elektronokat pedig úgy írják le, mint az elektronok.
az alábbi ábrán a p pályák kombinálódtak, és az elektronok delokalizáltak. Átlagosan az összes gyűrűkötés azonos.
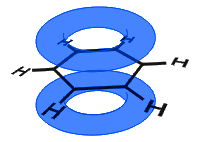
az alábbi példával ellentétben a benzolban lévő delokalizált elektronok a molekulán belül vannak, és nem szabadon mozognak az ömlesztett anyagon.
2. példa:
A fémek magas hő-és elektromos vezetőképességgel rendelkeznek, mivel atomjaik legkülső elektronjai delokalizálódnak. Ezek az elektronok nem kapcsolódnak semmilyen konkrét fémmaghoz, így szabadon mozoghatnak a fémben.
elismerés: a benzol pályáinak kék színű képei sansculotte jóvoltából készültek. Ezek a képek a Creative Commons Attribution-Share Alike 1.0 Általános licenc alatt vannak licencelve.