amerikai Pharm. 2008; 33(4)(onkológiai ellátás):20-30.
absztrakt: az emlőrákos posztmenopauzás nők körülbelül 75%-a hormonreceptor-pozitív (HR+) betegségben szenved.1 A Tamoxifen volt a HR+ mellrák kezelésének standardja posztmenopauzás nőknél a szelektív harmadik generációs aromatáz inhibitorok megjelenéséig, amelyek anasztrozol, letrozol és exemesztán.3,4 ezek a szerek a tamoxifennel végzett klinikai vizsgálatok során jobb betegségmentes túlélést mutattak, de előnyüket, ha több mint öt éven át alkalmazták posztmenopauzás, HR+ emlőrákban szenvedő nőknél, nem igazolták.3,4
becslések szerint az emlőrákos posztmenopauzás nők háromnegyedének hormonreceptor – pozitív (HR+) betegsége van.1 Tamoxifen-egy szelektív ösztrogén-receptor modulátor ösztrogén hatása a csont, endometrium szövet, és a lipidek és anti!= ösztrogén hatások az emlőszövetre — volt a HR+ mellrák standard terápiája posztmenopauzás nőknél a szelektív harmadik generációs aromatáz inhibitorok (AIs) bevezetéséig.2-4 ezek a szerek-anasztrozol, letrozol és exemestane-a klinikai vizsgálatokban a tamoxifenhez képest jobb betegségmentes túlélést (DFS) mutattak ki.3,4 a tamoxifen alkalmazásával kapcsolatos káros hatások-endometriális rák,tromboembóliás szövődmények és tamoxifen rezisztencia-más hatásmechanizmusú terápiák, például az AIs kifejlesztését ösztönözték.2
A harmadik generációs AI-kkel kapcsolatos fontos információk összefoglalását lásd az 1.táblázatban.
háttér
A Skót sebész George Beatson leírta az ösztrogének hormonális hozzájárulását a karcinogenezishez az emlőrákkal kapcsolatban 1896.5-ben Beatson felismerte, hogy a petefészkek eltávolítása (oophorectomia) előnyös volt a nőknél inoperábilis emlőrákkal.5 az ösztrogénhiány műtéti úton kiváltott állapota hozzájárult a tumor növekedésének gátlásához az emlőrákos sejtekben HR+ betegségben szenvedő nőknél.5
Az eredetileg görcsoldó szerként megfogalmazott aminoglutetimid volt az első nem specifikus AI, amelyet eredetileg az 1970-es évek végén népszerűsítettek második vonalbeli szerként a tamoxifen után előrehaladott HR+ emlőrákban szenvedő posztmenopauzás nők számára.6 a toxikus mellékhatások, mint például a mellékvese elnyomása és a szteroid terápia szükségessége az aminoglutetimid piacról való kivonásához vezetett.6 korai és késői stádiumú HR + emlőrákban szenvedő, posztmenopauzás nőknél a harmadik generációs mi-K jobb toxicitási profilt, nagyobb szelektivitást, nagyobb hatékonyságot és jobb klinikai hatékonyságot mutatnak a régebbi szerekhez képest. 6
Classification4,7
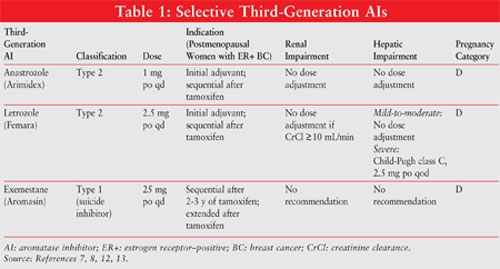
AIs az 1.típusú szteroid (nem versenyképes, irreverzibilis) vagy a 2. típusú nem szteroid (kompetitív, reverzibilis) inhibitorok közé tartozik. Az Exemestane, egy 1-es típusú inhibitor, irreverzibilisen kötődik az aromatáz molekula helyéhez, és öngyilkossági inhibitorként ismert. A 2-es típusú inhibitorok anasztrozol és letrozol reverzibilisen kötődnek az aromatázhoz. Lásd az 1. ábrát a különböző AI-k kémiai szerkezetéről.
hatásmechanizmus
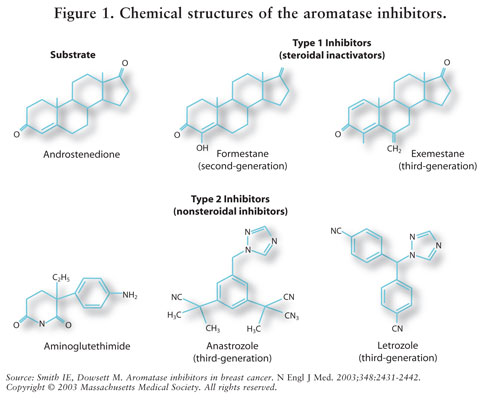
az ösztrogénszintézist az aromatáz enzim közvetíti.7 aromatáz átalakítja androstenedion és tesztoszteron ösztron és ösztradiol.Az 5,7 AIs csökkenti az ösztrogént a posztmenopauzás nőknél, ezáltal gátolja annak rákkeltő hatását az emlőszövetre.7 mivel a premenopauzás nők petefészkei még mindig működnek, a klinikai vizsgálatokon kívül az AIs nem javallt erre a populációra; ezeknél a nőknél az AIs stimulálná a hipotalamuszt és az agyalapi mirigyet a gonadotropinok termelésének fokozására.4 lásd a 2. ábrát.
Toxicitások6,8
az AIs káros hatásai közé tartozik a kardiovaszkuláris diszfunkció, például magas vérnyomás, értágulat, ödéma, és mellkasi fájdalom. További vizsgálat szükséges az AIs szívműködésre gyakorolt teljes hatásának értékeléséhez. A betegek csökkent csontsűrűséget (BMD), fokozott törésveszélyt, vazomotoros tüneteket, hüvelyszárazságot, mozgásszervi fájdalmat, fejfájást, álmatlanságot, depressziót, fokozott köhögést, nehézlégzést, gyomor-bélrendszeri diszkomfortot, súlygyarapodást és esetleg emelkedett lipidszintet tapasztalhatnak. A csontvesztés domináns mellékhatás; ennek ellensúlyozására biszfoszfonátokat, például zoledronsavat alkalmaztak. Az AIs-t kapó betegeknek D-vitamint és kalciumot kell kapniuk. Az AI terápia elhúzódó káros hatásait és a kognitív funkciókra gyakorolt hatásait még nem határozták meg.9 AIs ellenjavallt terhes nőknél.
Gyógyszerkölcsönhatások
Az anasztrozol gátolja a CYP1A2-t, a CYP2C9-et és a CYP3A4-et.10,11 a letrozolt a CYP2A6 és a CYP2C19 metabolizálja, és az exemesztán metabolizálja a CYP3A4-et.a 8,10-13 CYP3A4-induktorokat, például a rifampint, a fenitoint, a karbamazepint és az orbáncfüvet az exemesztán szintjének csökkenését okozhatja, ha egyidejűleg adják. 8,12,13 a Tamoxifen a letrozol 38%-os és az anasztrozol 27% – os csökkenését okozza, ha együtt adják.2,7,8,14
javallatok és adagolás
anasztrozol 10,11: napi egyszeri 1 mg anasztrozol korai emlőrák kezelésére javallott kezdeti adjuváns terápiaként hormonálisan érzékeny posztmenopauzás nőknél, valamint első vonalban HR+ vagy HR-ismeretlen metasztatikus vagy lokálisan előrehaladott betegség esetén. A tamoxifen terápiát követően progresszív betegségben szenvedő nőknél is engedélyezett. Vesekárosodás vagy enyhe-közepes fokú májkárosodás esetén nincs szükség dózismódosításra.
Letrozole11,12: letrozol 2.5 mg naponta egyszer HR+ korai stádiumú emlőrákban szenvedő posztmenopauzás nők számára javasolt kezdeti terápiaként vagy kiterjesztett adjuváns terápiaként a tamoxifen után. HR + vagy HR-ismeretlen metasztatikus betegség esetén is javallt. Súlyos májkárosodás esetén dózismódosítás javasolt.
Exemestane11,14: Az Exemestane 25 mg po naponta egyszer adjuváns terápiaként javallt két-három évvel a tamoxifen után HR+ korai emlőrákban szenvedő posztmenopauzális nőknél, összesen öt egymást követő hormonterápiában. Azt is fel lehet használni a betegség, amely előrehaladt után tamoxifen terápia. Étkezés után kell bevenni. A dózis módosítása nem szükséges máj-vagy vesekárosodás esetén
klinikai vizsgálatok
a tamoxifennel kapcsolatos toxicitások, mint például az endometrium rák, nagy léptékű klinikai vizsgálatok megkezdését eredményezték, amelyek a harmadik generációs AIs alkalmazását vizsgálták posztmenopauzás, HR+ emlőrákban szenvedő nőknél. Különböző próbaterveket alkalmaztak ezen szerek teljesítményének értékelésére a tamoxifenhez képest.6 a klinikai hatékonyság és a toxicitási profil szempontjából kiemelkedő eredmények az AIs-t az adjuváns terápia új standardjaként hozták létre HR+ emlőrákban szenvedő posztmenopauzás nőknél.6
ATAC15: ATAC (Arimidex, Tamoxifen önmagában vagy kombinációban), egy multicentrikus, randomizált, kettős-vak vizsgálat, három kezelési Kart hasonlított össze: 20 mg tamoxifen + anasztrozol placebo, 1 mg anasztrozol + tamoxifen placebo és 20 mg tamoxifen + 1 mg anasztrozol kombinációja. Az elsődleges cél a tamoxifen és az anasztrozol, valamint az anasztrozol és tamoxifen kombinációjának biztonságosságának és hatásosságának értékelése volt öt év alatt. Összesen 9366 beteget-3125-öt az anasztrozol-karon, 3116-ot a tamoxifen-karon és 3125-öt a kombinált karon-kezeltek átlagosan 33 hónapig.
három év elteltével az anasztrozol 89,4% – os DFS-t mutatott, szemben a tamoxifen 87,4% – ával (relatív hazárd 0,83, 95% CI , P =.013). Az anasztrozol csökkentette a kontralaterális emlőrák (CLBC) arányát a tamoxifenhez képest (esélyhányados 0,42, 95% CI , P =.007). A kombinációs Kart bezárták, mert a tamoxifenen túl nem találtak klinikai előnyt. Az anasztrozol olyan káros hatásokkal társult, mint az endometrium rák (P =.02), hüvelyi vérzés, kisülés (P <.0001), cerebrovascularis események (P=.0006), vénás thromboemboliás események (P=.0006) és hőhullámok (P <.0001); A tamoxifen kevesebb töréssel és kevesebb ízületi fájdalommal járt (P <.0001). 68 hónap elteltével az anasztrozol növelte a DFS-t (HR 0,87, 95% CI , P =.01) és a kiújulásig eltelt idő (HR 0,79, 95% CI, P =.0005) és csökkent távoli metasztázisok (HR 0,86, 95% CI, P =.04) és CLBC (42% – os csökkenés, P =.01).16 a 100 hónapos medián követési intervallum után az ANASZTROZOLLAL kezelt HR+ betegek javultak a DFS-ben (HR 0,85; P =.003), A CLBC előfordulása (HR 0,60, P =.004), az ismétlődésig eltelt idő (HR 0,76, P =.0001) és a távoli ismétlődésig eltelt idő (HR 0,84, P =.022) a tamoxifent szedő betegekkel összehasonlítva. Az ismétlődési arányok abszolút különbsége javult 2.8% öt év után 4,8% kilenc év után. Az anasztrozol törések aránya magasabb volt a terápia során, de a különbség jelentősen csökkent a 100 hónapos követési időszak után. A meghosszabbított terápiás periódus 1, 15-ös törésveszélyt jelentett anasztrozol esetén, szemben a tamoxifen 1, 02-vel. Az endometrium carcinoma kockázata az anasztrozol-kezelés során és azon kívül csökkent a tamoxifenhez képest, az éves arány 0, 043 volt, szemben a 0, 14-gyel és 0, 014, szemben a 0, 12-gyel. A teljes túlélés (os) különbségét nem azonosították.
MA.1712,17: MA.A 17 egy randomizált, placebo-kontrollos, kettős-vak vizsgálat volt, amely ötéves letrozol-kezelés hatékonyságát értékelte olyan posztmenopauzás emlőrákos nőknél, akik már befejezték az ötéves adjuváns tamoxifen terápiát. A betegek öt éven át naponta 2,5 mg letrozolt vagy placebót kaptak. Az elsődleges végpont a DFS volt; a másodlagos végpontok az életminőség, a kiterjesztett biztonságossági profil és az OS voltak. Az 5187 beteg közül 2593-an kaptak letrozolt és 2594-en placebót; a medián követési idő 2,4 év volt.
az előzetes analízis során 207 lokális vagy metasztatikus kiújulást észleltek emlőrákban vagy a CLBC kezdeti malignus tumoraiban, 75-öt a letrozol-csoportban és 132-et a placebo-csoportban. A tervezett négyéves DFS-arányok a két csoport esetében 93% , illetve 87% volt (P ?.001 a DFS értékeléséhez). A letrozol karban a DFS HR értéke 0,61 volt (95% CI , P ?.001). A letrozol az emlőrák incidenciájának 43% – os csökkenését mutatta (HR 0, 57 , 95% CI, P =.00008).4 a csomópont-pozitív betegek kivételével (P =.04), az OS nem érte el a statisztikai szignifikanciát (HR 0,82, P =.30).4 a letrozol-karon lévő betegek alacsony fokú vazomotoros tüneteket, myalgiát és arthritist tapasztaltak. Az Osteoporosis gyakoribb volt (bár nem szignifikáns) a letrozol-karon a placebóhoz képest (5, 8% vs.4, 5%; P=.07), és a törések aránya hasonló volt a karok között. A vizsgálatot medián 2,4 év elteltével zárták le, mivel a letrozol-karban csökkent az emlőrákos események száma. Kiterjesztett adjuváns terápia letrozollal az ötéves tamoxifen befejezése után javult a DFS.
BIG 1-987,9,18: A Breast International Group (BIG) 1-98 tanulmány, kettős-vak, multicentrikus, randomizált vizsgálat, 8028 posztmenopauzás nőt vett fel HR+ korai stádiumú emlőrákban. A tanulmány négy kezelési karból állt, amelyek öt év tamoxifen monoterápiát értékeltek, öt év letrozol monoterápiát, tamoxifent két évig, majd letrozolra váltást három évig, vagy letrozolt két évig, majd tamoxifenre váltást három évig. Az elsődleges cél a DFS volt; a másodlagos cél a távoli metasztázisig eltelt idő, a biztonságosság és az OS volt. A DFS emelkedett a letrozolt kapó betegeknél a tamoxifent kapókhoz képest (HR 0,81, 95% CI , relatív csökkenés 19%, P =.003), három év alatt 1,5% – os abszolút különbséggel. A Tamoxifen növelte a tromboembóliás események előfordulását a letrozollal összehasonlítva (vagy 0, 38, P <.0001). A letrozol karban a csonttörések száma emelkedett (vagy 1, 44, P =.006).
IES14,19: Az IES (Intergroup Exemestane Study) egy randomizált, kettős-vak, multicentrikus, fázis III vizsgálat volt, amelynek célja annak meghatározása volt, hogy az exemestane-ra való áttérés két-három év tamoxifen után hatékonyabb volt-e, mint a tamoxifen folytatása öt évig. A vizsgálatba 4742 posztmenopauzás nőt vontak be, akiket két kezelési karra randomizáltak; 2362 alanynak a tervek szerint két-három év 20 mg po qd tamoxifen után váltottak át Exemestane-ra, hogy öt évig befejezzék a terápiát, a fennmaradó 2380 pedig öt évig 20 mg po qd tamoxifent kapott. A DFS volt az elsődleges végpont; a másodlagos végpontok a teljes túlélés, a kiterjesztett toxicitási profil és a CLBC gyakorisága voltak.
A 30,6 hónapos medián időtartam alatt bekövetkezett nemkívánatos események közé tartozott a CLBC gyakorisága, a lokális vagy metasztatikus kiújulás és a halálozás. 449 esemény volt-183 az exemestane karban és 266 a tamoxifen karban. Az exemestane kar korrigálatlan HR értéke 0,68 volt (95% CI , P <.001 log-rank teszttel), amely a kockázat 32% – os csökkenését mutatta, és hasonló volt a DFS 4-es előnyéhez.75 (95% CI ) három év alatt. Három év elteltével az exemestane kar DFS-je 91,5% (95% CI ) volt, szemben a tamoxifen kar 86,8% – ával (95% CI). A két csoport között nem volt szignifikáns különbség az OS-ben: az exemestane-karban 93, a tamoxifen-karban pedig 106 haláleset történt. Jelentős különbség volt a CLBC gyakoriságában (P =.04) – 20 alany a tamoxifen karban és kilenc az exemestane karban. Az exemestane alkalmazása az ötéves kezelés befejezéséhez két-három éves tamoxifen után javította a DFS-t az öt éves tamoxifenhez képest.
megelőzése csontvesztés AI Therapy20
posztmenopauzás nők hajlamosak a fejlődő csökkent BMD miatt csökkent ösztrogén szint. A posztmenopauzás emlőrákos betegek AI-terápiája súlyosbítja ezt a tendenciát. A denoszumab, egy teljesen humán monoklonális vizsgálati antitest, kötődik a nukleáris faktor kB ligandum (RANKL) receptor aktivátorához, és megakadályozza a RANKL aktivitását. A RANKL létfontosságú az oszteoklasztikus aktivitáshoz, ami a csont lebontását jelenti. A denoszumabot és a biszfoszfonátot, a risedronátot vizsgálják, hogy képesek-e ellensúlyozni az AI-terápiával járó csontvesztést.
denoszumab-Vizsgálat20: egy multicentrikus, randomizált, III.fázisú vizsgálat értékelte a 60 mg denoszumab subcutan hathavonta történő alkalmazását posztmenopauzában lévő nőknél, akik AIs-t szedtek HR+ nemmetasztatikus emlőrák kezelésére. A cél az volt, hogy felmérjék az ágyéki-gerinc BMD változását a kiindulási értéktől 12 hónapig. A 252 beteg közül 127-et denoszumabbal, 125-öt pedig placebóval kezeltek. Mindkét kar kalciumot és D-vitamint kapott. a BMD-t kettős energiájú röntgenabszorpciós méréssel értékelték. 12, illetve 24 hónapos denoszumabbal vagy placebóval végzett kezelés után 5, 5%, illetve 7, 6%-os különbség volt a lumbális-gerinc régió BMD-növekedésében a denoszumab javára (P <.0001 mindkét hónapra). A denoszumab hasonló toxicitási profilt mutatott a placebóhoz képest. A denoszumab-kezelést több mint 24 hónapig még nem értékelték.
IBIS-II csont Sub-Study21: Az International Breast Cancer Intervention Study-II (IBIS-II) csont Alvizsgálatot az IBIS-II-ből származtatták, amely az emlőrák kialakulásának fokozott valószínűségével rendelkező posztmenopauzás nőket értékelte, akiket öt évig anasztrozolra vagy placebóra randomizáltak. Az alvizsgálat, a jelenlegi 700 beteg beiratkozásával, a risedronátot értékeli a placebóval szemben a BMD-veszteség megelőzésére azoknál a nőknél, akiknek a kiindulási t-pontszáma alacsony. Az IBIS-II vizsgálatból származó betegek egy részhalmazát az alvizsgálat három különböző kezelési stratégiájának egyikébe osztották be. Egyéves terápia után 350 anasztrozol és 350 placebo beteg kapott substudy eredményeket az IBIS-II-ben. Az 1. réteg 227 anasztrozollal kezelt betegből állt, normál T-pontszámmal (T-pontszám ?1), A 2.réteg 80 osteopeniában szenvedő beteget tartalmazott (++2,5 ? T-pontszám <1), akiket hetente egyszer 35 mg risedronáttal vagy placebóval kezeltek, és a 3.réteg 43 csontritkulásban szenvedő betegből állt (xia4 <T-pontszám <2,5), akiket hetente egyszer 35 mg risedronáttal kezeltek.
osteopeniában vagy osteoporosisban szenvedő betegeknél a kiindulási időpontban a rizedronát gátolta az anasztrozollal összefüggő csontvesztést. Stratum II-ben a rizedronát kedvező hatást mutatott a BMD megőrzésére a teljes csípő, de nem az ágyéki gerinc (P =.005 és P =.15, ill.placebo). A risedronáttal nem társultak súlyos mellékhatások vagy Gyógyszerkölcsönhatások.
az AIs vizsgálata premenopauzás nőknél (SOFT)21-26
az 50 év alatti nők körülbelül 33% – át invazív emlőrákkal diagnosztizálják. 22 a petefészek működésének elnyomása vizsgálat (SOFT, IBCSG 24-02, BIG 2-02) az AI terápia alkalmazását vizsgálja HR+ mellrákos premenopauzás nőknél. A vizsgálat, amelynek célzott betegfelvételi száma 3000, premenopauzás nőket érint HR + emlőrákban, akik kemoterápiát végeztek, vagy akik csak műtétet kaptak. A petefészek ablációját a triptorelin (gonadotropint felszabadító hormon) öt éven át havonta egyszer, műtéti oophorectomia vagy kismedencei besugárzás. A betegeket a három kar egyikébe randomizálják, az első kar öt éven át naponta egyszer tamoxifent kap, a második kar öt évig tamoxifent kap petefészek ablációval kombinálva, a harmadik kar pedig öt évig Exemestane-t kap petefészek ablációval kombinálva. A betegek öt évig kapnak exemestane-t vagy tamoxifent.
kemoprevenciós Próbák23-27
A Tamoxifen emlőrák kemoprevenciójára javallt.6 toxicitási profilja a terápiás alkalmazás szempontjából kényszerítő tényező.6 az AIs csökkentheti a HR+ emlőrák incidenciáját a magas kockázatú betegeknél, mivel a clbc incidenciája a tamoxifenhez képest csökkent az olyan klinikai vizsgálatokban, mint az ATAC.6
az AI kemoprevenciós vizsgálatok közé tartozik az International Breast Cancer Study Group (IBCSG) 31-03 (IBCSG 31-03) vizsgálat és a Kanadai Nemzeti Rákkutató Intézet térképe.3 próba. A multicentrikus, nemzetközi, randomizált, placebo-kontrollos IBCSG 31-03 vizsgálat elsődleges célja az anasztrozol alkalmazásának értékelése az emlőrák megelőzésére posztmenopauzás nőknél. Elsődleges eredménymérője az invazív és nem invazív emlőrák előfordulása; a másodlagos kimenetel mértéke az osteoporosis és a törések előfordulása.5 az IBCSG 31-03 vizsgálat célja 6000 beiratkozás. A térkép.3 a vizsgálat az exemesztánt kemopreventív szerként értékeli posztmenopauzás nőknél. A placebo-kontrollos MAP elsődleges célja.3 a vizsgálat célja az exemestane hatékonyságának felmérése az invazív emlőrák előfordulásának csökkentésében.
lehetséges jövőbeli felhasználások: esettanulmányok
letrozolt alkalmaztak, miután a klomifen nem indukálta a termékenységet 22 policisztás petefészek szindrómában szenvedő nőnél. A letrozol a ciklusok 75% – ában indukálta az ovulációt, szemben a klomifén által kiváltott ciklusok 44,4% – ával. Négy terhesség következett be a letrozol által kiváltott ovulációkból, és a letrozollal nem volt jelentős mellékhatás.28,29
egy hysterectomia és bilaterális salpingo-oophorectomia után endometriosisban szenvedő 57 éves elhízott nő kapott anastrozolt a megestrol terápia után. A betegnek kilenc hónap után nem volt endometriális elváltozása.28,30
egy McCune-Albright-szindrómában szenvedő betegnek anasztrozolt adtak a korai pubertás idejére; a beteg ösztradiolszintje 2,5 év anasztrozol után normalizálódott, és a csontok életkora hat hónappal előrehaladt.28,31 a megnövekedett ösztrogén gynecomastia és hypogonadotrop hypogonadismust okozhat.28,31 csökkenő ösztrogén egy AI eredményezett normál gonadotropin és tesztoszteron férfiaknál gynecomastia és hypogonadotrop hypogonadismus. 28,31,32
a letrozolt relapszusos petefészekrákban szenvedő betegeknél vizsgálták; azoknál a betegeknél, akik letrozolt kaptak, a betegség stabilizálódott.28,33 neoadjuváns letrozolt adtak 10 posztmenopauzás, endometriális rákban szenvedő nőnek; a gyógyszer konstruktív klinikai változásokat mutatott, és nem volt negatív sebészeti hatása.28,34
amikor a testolakton és az anasztrozol kezelést összehasonlították terméketlen férfiaknál, a két szer hatékonysága hasonló volt.28,35 Klinefelter-szindrómás beteg hatékonyabb kezelést kapott testolaktonnal, mint anasztrozollal.28,35
következtetések
A harmadik generációs AI-k kiváló DFS-t mutattak a posztmenopauzás nőknél HR+ emlőrákban, de a több mint öt éves AI-terápia klinikai előnye ezeknél a betegeknél nem igazolták.4 A Nemzeti sebészeti adjuváns mell-és Bélprojekt (NSABP) B-33 (exemestane) vizsgálat és az MA későbbi randomizálása.17 (letrozol) vizsgálat megvizsgálja ezen AIs alkalmazását a placebóval szemben további öt évig.4 AIs megfelelő alternatíva a HR + posztmenopauzás nők számára, akiknél a tamoxifen ellenjavallt.4
a harmadik generációs AI-k kedvező hatásai közé tartozik a tolerálhatóbb toxicitási profil és a tamoxifenhez képest jobb DFS. Ezen szerek és a tamoxifen hatásossága összehasonlítható. Továbbra is bizonytalan a kezelés kiválasztott időtartama, a hosszú távú toxicitási profil és az AIs megfelelő beadási sorrendje.4 új vizsgálat szükséges szelektív aromatáz modulátorok előállításához, amelyek kevesebb toxicitást eredményeznek, mint az AIs.25,36-37
1. Robertson JFR. Fulvesztrant(Faslodex) — hogyan lehet egy jó gyógyszer jobb. Onkológus . 2007;12:774-784.
2. Osborne CK. Gyógyszeres kezelés: tamoxifen az emlőrák kezelésében. N Engl J Med. 1998;339:1609-1618.
3. Országos Rák Átfogó Hálózat. NCCN klinikai gyakorlati irányelvek az onkológiában — V.1. 2008. Mellrák. www.nccn.org/professionals/physician_gls/f_guidelines.asp. hozzáférés október 11, 2007.
4. Winer EP, Hudis C, Burstein HJ, et al. Amerikai Klinikai Onkológiai Társaság technológiai értékelése az aromatáz inhibitorok adjuváns terápiaként történő alkalmazásáról hormonreceptor-pozitív emlőrákban szenvedő posztmenopauzás nők esetében: állapotjelentés 2004. J Clin Oncol . 2005;23:619-629.
5. Dunn BK, Wickerham DL, Ford LG. A hormonokkal kapcsolatos rákok megelőzése: mellrák. J Clin Oncol. 2005;23:357-367.
6. Smith IE, Dowsett M. aromatáz inhibitorok emlőrákban. N Engl J Med. 2003;348:2431-2442.
7. Goss PE, Strasser K. Aromatáz inhibitorok az emlőrák kezelésében és megelőzésében. J Clin Oncol . 2001;19:881-894.
8. Lacy CF, Armstrong LL, Goldman MP, et al, Szerk. Kábítószer-Információs Kézikönyv. 13. kiadás. Hudson, OH: Lexi-Comp; 2005: 117 598 871.
9. Ellis MJ, Szerk. Aromatáz inhibitorok az emlőrák kezelésére. Manhasset, NY: onkológiai kiadói csoport, CMP Healthcare Media; 2005: 29-45.
10. Arimidex (anasztrozol) betegtájékoztató. Wilmington, DE: AstraZeneca Pharmaceuticals LP; 2007. május.
11. Arora A, Potter JF. Aromatase inhibitors: current indications and future prospects for treatment of postmenopausal breast cancer. J Am Geriatr Soc. 2004;52:611-616.
12. Femara (letrozole) package insert. East Hanover, NJ: Novartis Pharmaceuticals Corp; December 2006.
13. Shaw G. In preventing breast cancer occurrence…anastrozole beats tamoxifen in ATAC. Clin Oncol News . 1/2008. www.clinicaloncology.com/index.asp?ses=ogst§ion_id=148&show=osztály&cikk_id=9884. Hozzáférés Március 17, 2008.
14. Aromasin (exemestane) betegtájékoztató. New York, New York: Pfizer Inc; 2007. Február.
15. Baum M, Budzar AU, Cuzick J, et al, az ATAC Trialisták csoportja számára. Anasztrozol önmagában vagy tamoxifennel kombinálva, szemben az önmagában adott tamoxifennel posztmenopauzás, korai emlőrákban szenvedő nők adjuváns kezelésére: az ATAC randomizált vizsgálatának első eredményei. Lancet. 2002;359:2131-2139.
16. Howell A, Cuzick J, Baum M, et al, az ATAC Trialisták csoportja számára. Az ATAC (Arimidex, Tamoxifen, önmagában vagy kombinációban) vizsgálat eredményei az emlőrák 5 éves adjuváns kezelésének befejezése után. Lancet. 2005;365:60-62.
17. Goss PE, Ingle JN, Martino S, et al. A letrozol randomizált vizsgálata posztmenopauzás nőknél öt év tamoxifen terápia után korai stádiumú emlőrák esetén. N Engl J Med. 2003;349:1793-1802.
18. Thrlimann B, Keshaviah a, Coates AS, et al, A Breast International Group (BIG) 1-98 együttműködési csoport számára. A letrozol és a tamoxifen összehasonlítása posztmenopauzás, korai emlőrákban szenvedő nőknél. N Engl J Med. 2005;353:2747-2757.
19. Coombes RC, Hall E, Gibson LJ, et al, az Intergroup Exemestane tanulmányhoz. Az exemestane randomizált vizsgálata két-három éves tamoxifen terápia után posztmenopauzás, primer emlőrákos nőknél. N Engl J Med. 2004; 350:
1081-1092.
20. Ellis G, Bone HG, Chlebowski R, et al. A denoszumab-terápia csont ásványi sűrűségre gyakorolt hatásának 3. fázisú vizsgálata nem metasztatikus emlőrák miatt aromatáz inhibitorokat kapó nőknél. Papír bemutatott: a 30. éves San Antonio Mellrák Szimpózium; December 13-16, 2007; San Antonio, TX. Absztrakt 47.
21. Singh S, Cuzick J, Edwards R, et al. Az anasztrozol hatása a csont ásványi sűrűségére egy év kezelés után: a nemzetközi emlőrák intervenciós vizsgálat (IBIS-II) csont alvizsgálatának eredményei. A következő címen bemutatott papír: a 30. éves San Antonio Mellrák Szimpózium; December 13-16, 2007; San Antonio, TX. Absztrakt 28.
22. Dellapasqua S, Colleoni M, Gelber RD, Goldhirsch A. adjuváns endokrin terápia korai emlőrákos premenopauzás nők számára. J Clin Oncol. 2005;23:1736-1750.
23. Nemzeti Rák Intézet. Mellrák kezelés (PDQ). www.cancer.gov/cancertopics/pdq/treatment/breast/healthprofessional. hozzáférés December 26, 2007.
24. Baylor Orvostudományi Főiskola klinikai vizsgálatok. A petefészek működésének elnyomása (puha). www.breastcenter.tmc.edu/clinic/trials/soft.htm. hozzáférés December 26, 2007.
25. Aebi S, Castiglione-Gertsch M. adjuváns endokrin terápia a nagyon fiatal betegek számára. Mell. 2003;12:509-515.
26. ClinicalTrials.gov. a petefészek működésének elnyomása, plusz akár tamoxifen, akár exemestane, összehasonlítva a tamoxifennel önmagában a premenopauzás nők kezelésében hormonra reagáló emlőrákban. www.clinicaltrials.gov/. hozzáférés December 26, 2007.
27. Cuzick J. Aromatáz inhibitorok az emlőrák megelőzésére. J Clin Oncol. 2005;23:1636-1643.
28. Karaer O, Oru s, Koyuncu FM. Aromatáz inhibitorok: lehetséges jövőbeli alkalmazások. Acta Obstet Gynecol Scand. 2004:83:699-706.
29. Mitwally MF, Casper RF. Aromatáz inhibitor alkalmazása ovuláció indukálására olyan betegeknél, akiknél a klomifen-citrátra nem megfelelő válasz van. Fertil Steril. 2001;75:305-309.
30. Bulun SE, Yang S, Fang Z, et al. Az aromatáz szerepe az endometriális betegségben. J Szteroid Biochem Mol Biol. 2001;79:19-25.
31. F. A., B. A., B. A., B. A., B. A., B. A., B. A., B. A., B. Aromatáz inhibitorok alkalmazása korai pubertásban. Endocr Relat Rák. 1999;6:303-306.
32. Shozu M, Sebastian S, Takayama K, et al. Ösztrogénfelesleg, amely az aromatáz gént befolyásoló új funkcióerősítési mutációkhoz kapcsolódik. N Engl J Med. 2003;348:1855-1865.
33. Bowman A, Gabra H, Langdon SP, et al. A CA 125 válasz az ösztrogénreceptor expressziójához kapcsolódik a letrozol II. fázisú vizsgálatában petefészekrákban: endokrin-érzékeny alcsoport azonosítása. Clin Rák Res. 2002; 8: 2233-2239.
34. Berstein L, Maximov S, Gershfeld E, et al. Az endometriális rák neoadjuváns kezelése az aromatáz inhibitor letrozollal: endokrin és klinikai hatások. Eur J Obstet Gynecol Reprod Biol. 2002;105:161-165.
35. Raman JD, Schlegel PN. Aromatáz inhibitorok férfi meddőség esetén. J Urol. 2002;167:624-629.
36. Simpson ER, Dowsett M. aromatáz és inhibitorai: jelentősége az emlőrák kezelésében. Legutóbbi Prog Horm Res. 2002;57: 317-338.