a voltaic cella, gyakran galvanikus cella néven ismert, elektromos energiát biztosít. Ennek az energiának a forrása spontán kémiai reakció, pontosabban spontán redox reakció.
például az összes elem egy vagy több voltaic cellából készül;az elemek lemerülnek, amikor a reagensek nagy részét vagy egészét termékekké alakították át, kémiai potenciális energiájukat elektromos energiává alakítva.
Voltaic Cells-az alapvető folyamat
kémiai potenciális energia ^ elektromos energia
a voltaic cella az elektrokémiai cellák két alapvető típusának egyike.A másik típus az elektrolitikus cella; egy elektrolitikus cellában az elektromos energiát nem spontán kémiai reakció vezetésére használják.Például a víz hidrogénre és oxigénre osztható egy elektrolitikus cellában. Továbbá, ha egy újratölthető akkumulátort újratöltenek, elektrolitikus cellaként működik.
alapvető Voltaic cella sematikus
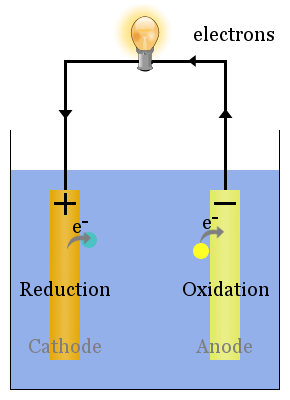
spontán redox reakciók az elektródákon feszültséget hoznak létre.Helyesen beállítva, ez a feszültség elektromos eszközökön keresztül vezetheti az elektronokat, például a bemutatott villanykörtét here.In ez a diagram, a fajok elektronokat visznek az anódba, ahonnan a villanykörtén át a katódig áramlanak, ahol redukciót eredményeznek.
alapvető elektrolitikus cellák vázlata
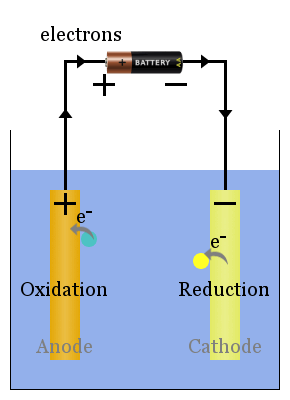
nem spontán a redox reakciókat külső feszültség hajtja.Az elektrolitikus cella folyamatai ellentétesek a voltaic celláéval.az áramforrás áramlása az elektronokat a katódra tolja, ahol a fajok csökkenését okozzák.
itt olvashat bővebben a voltaic vs elektrolitikus cellák katódjairól és anódjairól.
példa egy Voltaic cellára
az Edison akkumulátor
az Edison akkumulátor egy egyszerű, újratölthető cella, amelyet Thomas talált ki Edison.It két fém elektródából áll, az egyik vasból, a másik nikkelből.A kezdeti töltés során nikkel-oxid bevonat képződik a nikkel-elektródon.
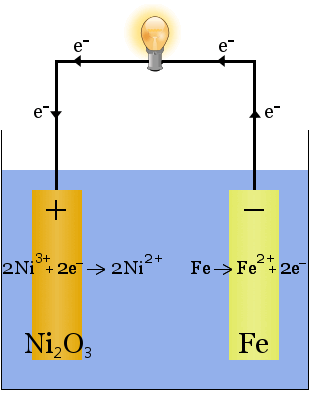
az elektrolit (az elektródák közötti Ionos folyadék) 20-30 tömegszázalék kálium-hidroxid vízben.A kálium-hidroxid szerepe ebben az esetben az ionos vezetőképesség növelése az elektromos áramkör befejezéséhez – a reakcióban kálium-hidroxidot nem fogyasztanak.
amikor kisül, az Edison sejt voltaic cellaként működik.Töltés közben a cella elektrolitikus cellaként működik.
az elektródák reakcióinak kémiai egyenletei a következők:
a kisülés során, amikor a cella elektromos energiát szolgáltat, a fenti reakciók a jobb oldalon folytatódnak.
töltés közben, amikor a cella elektromos energiát alakít át kémiai potenciális energiává, a fenti reakciók a bal oldalon folytatódnak.
az Edison-cella, mindkét elektróda ugyanazzal az elektrolittal rendelkezik, a gyakorlati alkalmazás egyik legegyszerűbb voltaic-cellája; a legtöbb voltaic sejt bonyolultabb.Nagy előnye, hogy figyelemre méltó robusztus az olyan hibákkal szemben, mint a túltöltés, és nagyon hosszú élettartama, szinte korlátlan töltési-kisülési ciklussal.
legnagyobb hátránya, hogy az energiateljesítményéhez képest nagyon nehéz.
további példa
lítium akkumulátorok
Az akkumulátor-technológia fejlődése az elektronikus eszközök miniatürizálását eredményezte.Ezen előrelépések nélkül a modern eszközök, például a mobiltelefonok és a táblagépek nagyobbak és nehézkesebbek lennének.
ezeknek az előrelépéseknek a középpontjában a lítium-ion technológia állt.A lítium elem nagyon alacsony sűrűségű fém: 0,534 g/cm3 a lítium fele olyan sűrű, mint a víz; a lítium úszik a vízen.Hasonlítsa össze ezt az Edison cellában lévő fémekkel, a nikkel sűrűsége 8,908 g/cm3, a vasé pedig 7,874 g/cm3: ezek több mint 10-szer magasabbak, mint a lítium sűrűsége.
a lítium magas redoxpotenciálja az alacsony sűrűséggel kombinálva tökéletessé teszi ionjait akkumulátor anyagként való használatra.
egy tipikus lítium-ion akkumulátor porózus elektródákon alapul, amelyek lehetővé teszik a Li-ionok pórusaikba történő be-és kilépését.Például egy újratölthető lítium-ion akkumulátornak lehet egy grafitelektródja és egy lítiummal adalékolt kobalt-oxid elektróda, amely a lipf6 sót tartalmazó polioxietilén elektrolitot tartalmaz.
amikor egy ilyen akkumulátor táplálja a készüléket, a grafit anód rétegszerkezetében lévő lítium atomok oxidálódnak, hogy ionokká váljanak.
a katódnál a lítium-ionok a kobalt-oxid szerkezetében redukálódnak.
These reactions are reversed when the cell is being charged.
