a legtöbb bakteriális fertőzés kezelhető antibiotikumokkal, például penicillinnel, amelyet évtizedekkel ezelőtt fedeztek fel. Az ilyen gyógyszerek azonban haszontalanok a vírusfertőzések, köztük az influenza, a megfázás és a halálos vérzéses lázak, például az Ebola ellen.
most, egy olyan fejlesztésben, amely átalakíthatja a vírusfertőzések kezelését, az MIT Lincoln Laboratóriumának kutatócsoportja olyan gyógyszert tervezett, amely képes azonosítani azokat a sejteket, amelyeket bármilyen típusú vírus fertőzött meg, majd megöli ezeket a sejteket, hogy megszüntesse a fertőzést.
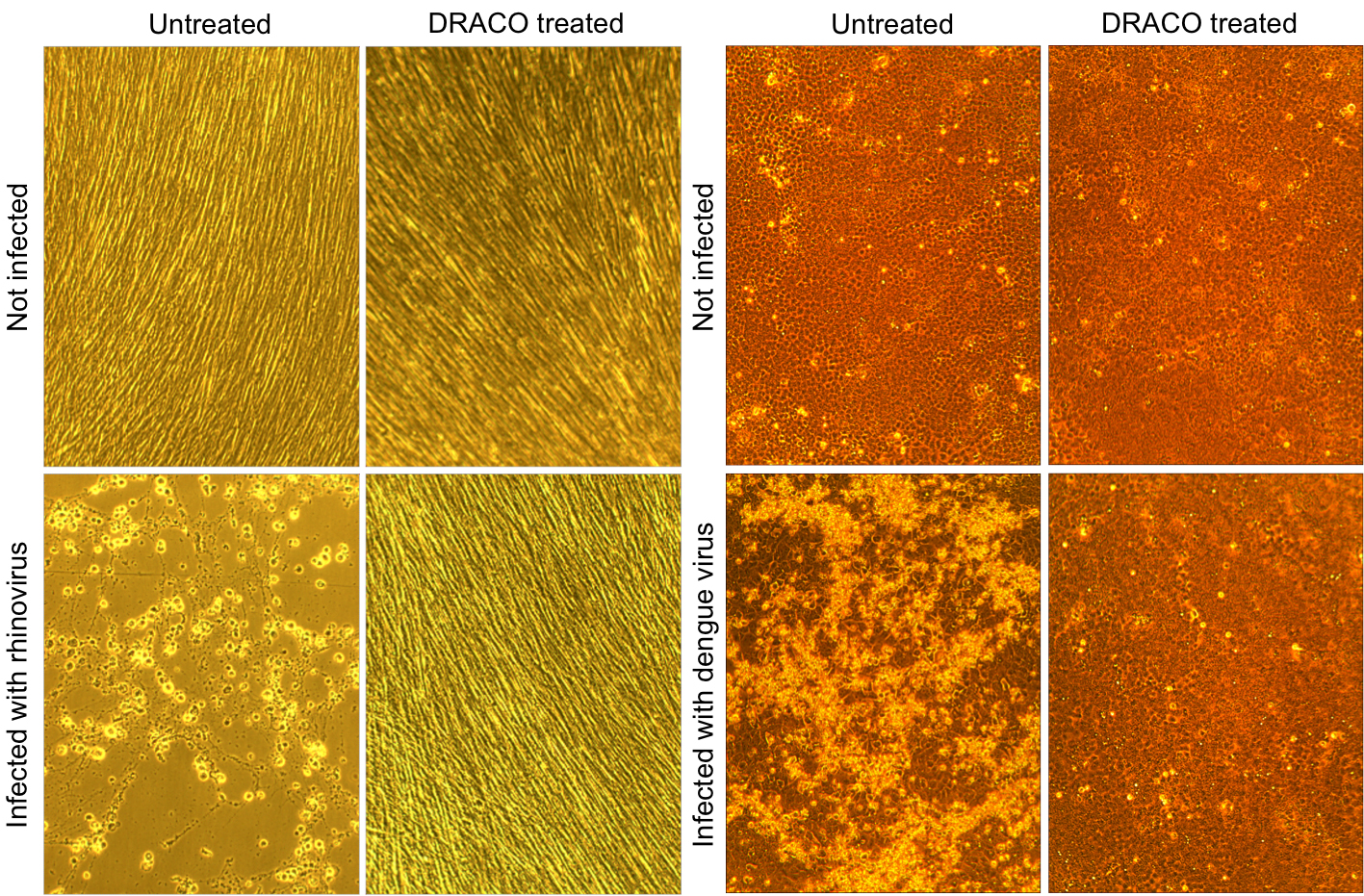
a fenti mikroszkóp képek azt mutatják, hogy a Draco sikeresen kezeli a vírusfertőzéseket. A bal oldali négy fotósorozatban a rhinovírus (a közönséges hideg vírus) megöli a kezeletlen emberi sejteket (bal alsó rész), míg a DRACO nem mérgező a nem fertőzött sejtekben (jobb felső rész), és meggyógyítja a fertőzött sejtpopulációt (jobb alsó rész). Hasonlóképpen, a jobb oldali négy fotóban a dengue hemorrhagiás láz vírus megöli a kezeletlen majomsejteket (bal alsó), míg a DRACO nem mérgező a nem fertőzött sejtekben (jobb felső) és meggyógyítja a fertőzött sejtpopulációt (jobb alsó). / Enlarge image
a PLoS One folyóiratban július 27 — én megjelent tanulmányban a kutatók 15 vírus ellen tesztelték gyógyszerüket, és azt találták, hogy mindegyik ellen hatásos-beleértve a rhinovírusokat, amelyek a megfázást, a H1N1 influenzát, a gyomorvírust, a polio vírust, a dengue-lázot és számos más típusú vérzéses lázot okoznak.
a gyógyszer úgy működik, hogy olyan típusú RNS-t céloz meg, amelyet csak a vírusokkal fertőzött sejtekben termelnek. “Elméletileg minden vírus ellen működnie kell” – mondja Todd Rider, a Lincoln Laboratory Kémiai, Biológiai és nanoméretű technológiák csoportjának vezető munkatársa, aki feltalálta az új technológiát.
mivel a technológia olyan széles spektrumú, potenciálisan felhasználható új vírusok kitörésének leküzdésére is, mint például a 2003-as SARS (súlyos akut légzőszervi szindróma) járvány, mondja Rider.a kutatócsoport további tagjai a Lincoln Lab munkatársai, Scott Wick, Christina Zook, Tara Boettcher, Jennifer Pancoast és Benjamin Zusman.
kevés vírusellenes szer áll rendelkezésre
Rider ötlete volt, hogy megpróbál egy széles spektrumú vírusellenes terápiát kifejleszteni körülbelül 11 évvel ezelőtt, miután feltalálta a CANARY-t (celluláris elemzés és az antigén kockázatok és hozamok bejelentése), egy bioszenzort, amely gyorsan képes azonosítani a kórokozókat. “Ha kórokozó baktériumot észlel a környezetben, valószínűleg van egy antibiotikum, amelyet fel lehet használni az ennek kitett személyek kezelésére, de rájöttem, hogy nagyon kevés víruskezelés létezik” – mondja.
van egy maroknyi gyógyszer, amely specifikus vírusokkal küzd, mint például a HIV-fertőzés kezelésére használt proteáz inhibitorok, de ezek száma viszonylag kevés, és érzékenyek a vírusrezisztenciára.
Rider az élő sejtek saját védelmi rendszereiből merített ihletet Dracos (kettős szálú RNS-aktivált kaszpáz Oligomerizátorok) névre keresztelt terápiás szereihez.
amikor a vírusok megfertőznek egy sejtet, átveszik annak sejtszerkezetét saját céljaikra — vagyis a vírus több példányának létrehozására. E folyamat során a vírusok hosszú, kettős szálú RNS-t (dsrns) hoznak létre, amely nem található meg az emberi vagy más állati sejtekben.
a vírusfertőzés elleni természetes védekezésük részeként az emberi sejtek olyan fehérjékkel rendelkeznek, amelyek a dsrns-re rögzülnek, elindítva a reakciók kaszkádját, amely megakadályozza a vírus replikálódását. Sok vírus azonban túljárhat ezen a rendszeren, ha blokkolja a kaszkád egyik lépését.
Ridernek az volt az ötlete, hogy kombináljon egy dsrns-kötő fehérjét egy másik fehérjével, amely a sejteket apoptózisra (programozott sejt öngyilkosság) indukálja — például akkor, amikor egy sejt meghatározza, hogy rákos lesz. Ezért, amikor a DRACO egyik vége kötődik a dsrns-hez, jelzi a DRACO másik végét, hogy kezdeményezze a sejt öngyilkosságát.
E két elem kombinálása “nagyszerű ötlet” és nagyon újszerű megközelítés, mondja Karla Kirkegaard, a Stanford Egyetem mikrobiológiai és immunológiai professzora. “A vírusok nagyon jól képesek rezisztenciát kialakítani azokkal a dolgokkal szemben, amelyeket ellenük próbálunk ki, de ebben az esetben nehéz elképzelni egy egyszerű utat a kábítószer-rezisztencia felé” – mondja.
Minden DRACO tartalmaz egy “szállítási címkét”, amely a természetben előforduló fehérjékből származik, amely lehetővé teszi, hogy áthaladjon a sejtmembránokon, és belépjen bármely emberi vagy állati sejtbe. Ha azonban nincs dsrns, a DRACO sértetlenül hagyja el a sejtet.
Az ebben a tanulmányban közölt tesztek többségét laboratóriumi körülmények között tenyésztett emberi és állati sejteken végezték, de a kutatók a DRACO-t H1N1 influenzavírussal fertőzött egereken is tesztelték. Amikor az egereket DRACO-val kezelték, teljesen meggyógyultak a fertőzésből. A tesztek azt is kimutatták, hogy maga a DRACO nem mérgező az egerekre.
a kutatók most tesztelik a DRACO-t több vírus ellen egerekben, és ígéretes eredményeket kapnak. Rider azt mondja, reméli, hogy engedélyezi a technológiát a nagyobb állatokon végzett kísérletekhez és az esetleges emberi klinikai vizsgálatokhoz.
ezt a munkát a National Institute of Allergy and Infectious Diseases és a New England Regional Center of Excellence for Biodefense and Emerging Infectious Diseases támogatásával finanszírozzák, korábbi finanszírozással a Defense Advanced Research Projects Agency, A Defense Threat Reduction Agency és a Defense Research igazgatója & Engineering (jelenleg a kutatási és mérnöki védelmi miniszter helyettese).