a hibridizációs elméletet gyakran hosszú és zavaros koncepciónak tekintik, és hasznos képesség, hogy gyorsan meg tudjuk határozni, hogy az atom sp3, sp2 vagy sp, anélkül, hogy át kellene mennünk a hibridizáció minden részletén.
szerencsére van egy parancsikon ennek végrehajtásában, és ebben a bejegyzésben megpróbálom összefoglalni ezt néhány különálló lépésben, amelyeket követnie kell.
tegyük fel, hogy meg kell határoznia a következő molekula számozott atomjainak hibridizációs állapotát:

az első dolog, amit meg kell tennie, az egyes atomokon lévő csoportok számának meghatározása. Csoportok alatt atomokat vagy magányos elektronpárokat értünk. Ezt Szterikus számnak (SN) is nevezik.

Az alábbiakban bemutatunk néhány példát a 2-4-es szterikus számokra, amelyeket nagyrészt tudnia kell a szerves kémiában:

figyeljük meg, hogy több kötés nem számít, atomok + magányos Párok bármilyen kötéstípushoz.
miután megtudta, hogyan kell meghatározni a szterikus számot (ez a VSEPR elméletből származik), egyszerűen a következő korrelációt kell alkalmaznia:
ha a szterikus szám 4, akkor sp3
ha a szterikus szám 3 – sp2
ha a szterikus szám 2 – SP
tehát most térjünk vissza a molekulánkhoz, és határozzuk meg az összes atom hibridizációs állapotát.
C1 – SN = 3 (három összekapcsolt Atom), ezért sp2
C2 – SN = 3 (három összekapcsolt Atom), ezért sp2
O4 – SN = 3 (1 atom + 2 magányos pár), ezért sp2
O5 – SN = 4 (2 Atom + 2 magányos pár), ezért sp3
C6 – SN = 4 (4 Atom), ezért SP3
C6 – SN = 4 (4 Atom), tehát ez SP3
C7 – SN = 4 (4 Atom), ezért SP3
N8 – SN = 4 (3 atom + 1 magányos pár), ezért SP3
C9 – SN = 2 (2 Atom), ezért sp
C10-SN=2 (2 Atom), ezért SP

amellett, hogy ez a módszer, az is nagyon hasznos, hogy emlékezzen néhány vonások kapcsolódó szerkezet és hibridizáció. Általában az összes kötéssel rendelkező atom SP3 hibridizált. A legjobb példa az alkánok. Az alkán összes szénatomja SP3 hibridizált tetraéderes geometriával.
az alkénekben és más kettős kötésű atomokban lévő szénatomok gyakran SP2 hibridizáltak és trigonális sík geometriájúak.
a hármas kötés viszont az alkinekre jellemző, ahol a szénatomok sp-hibridizálódnak.
van néhány általános kivétel, amit a hibridizációs állapot meghatározásáról tárgyaltunk, és ezek leginkább az atom kötési típusát vizsgáló módszerhez kapcsolódnak.
például a szén-dioxidban (CO2) a szénnek két kettős kötése van, de sp-hibridizált.
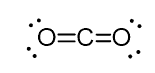
és ennek oka az a tény, hogy a szén szterikus száma két (csak két oxigénatom kapcsolódik hozzá), és annak érdekében, hogy két atom 180o-on maradjon, ami az optimális geometria, a szénnek két azonos pályát kell használnia. Ez csak az sp hibridizációban lehetséges. A másik két 2P pályát a szén mindkét oldalán kettős kötések készítésére használják.
egy másik gyakori és nagyon fontos példa a karbokációk.

itt a szénnek csak egyetlen kötése van, és úgy tűnhet, hogy SP3 hibridizált. Az ilyen típusú karbokációkban a szén azonban SP2 hibridizált. Ismét ugyanezen okból, hogy a szterikus száma 3 (sp2 – három azonos pálya).
kivétel a Szterikus szám módszer alól
az egyik kivétel a szterikus számmal például az amidok. A nitrogénatom itt 4-es szterikus számmal rendelkezik, és várhatóan sp3 lesz. A magányos pár rezonancia delokalizációja miatt azonban SP3-ról sp2-re változik, mivel ez az egyetlen módja annak, hogy az elektronok egy igazított p pályán legyenek, amely átfedésben lehet és részt vehet a rezonancia stabilizálásában a Pi kötés elektronjaival C=O kettős kötés.

a legtöbb esetben nem kell aggódnia a kivételek miatt, ha a Szterikus szám alapján megy.