enzimatikus katalízis mechanizmusai
a szubsztrát kötődése az enzim aktív helyéhez nagyon specifikus kölcsönhatás. Az aktív helyek egy enzim felületén lévő hasadékok vagy hornyok, amelyek általában a polipeptidlánc különböző részeiből származó aminosavakból állnak, amelyeket a hajtogatott fehérje tercier szerkezetében hoznak össze. A szubsztrátok kezdetben nem-kovalens kölcsönhatások révén kötődnek az aktív helyhez, beleértve a hidrogénkötéseket, az ionos kötéseket és a hidrofób kölcsönhatásokat. Miután egy szubsztrát kötődik egy enzim aktív helyéhez, több mechanizmus felgyorsíthatja annak átalakulását a reakció termékévé.
bár az előző szakaszban tárgyalt egyszerű példa csak egyetlen szubsztrátmolekulát érintett, a legtöbb biokémiai reakció két vagy több különböző szubsztrát közötti kölcsönhatást foglal magában. Például egy peptidkötés kialakulása két aminosav összekapcsolását jelenti. Ilyen reakciók esetén két vagy több szubsztrát megfelelő helyzetben és tájolásban történő kötődése az aktív helyhez felgyorsítja a reakciót (2.23.ábra). Az enzim olyan sablont biztosít, amelyre a reagenseket összehozzák, és megfelelően orientálják, hogy elősegítsék az átmeneti állapot kialakulását, amelyben kölcsönhatásba lépnek.

2.23.ábra
két szubsztrát közötti reakció enzimatikus katalízise. Az enzim olyan sablont biztosít, amelyen a két szubsztrát a megfelelő helyzetben és orientációban kerül egymáshoz, hogy egymással reagáljanak.
az enzimek felgyorsítják a reakciókat azáltal is, hogy megváltoztatják szubsztrátjaik konformációját, hogy megközelítsék az átmeneti állapotot. Az enzim-szubsztrát kölcsönhatás legegyszerűbb modellje a lock-and-key modell, amelyben a szubsztrát pontosan illeszkedik az aktív helyre (2.24.ábra). Sok esetben azonban mind az enzim, mind a szubsztrát konfigurációját szubsztrátkötéssel módosítják—ezt a folyamatot indukált illesztésnek nevezik. Ilyen esetekben a szubsztrátum konformációja megváltozik, így jobban hasonlít az átmeneti állapothoz. A szubsztrátum ilyen torzulása által előidézett feszültség a kritikus kötések gyengítésével tovább megkönnyítheti átmeneti állapotba való átalakulását. Ezenkívül az átmeneti állapotot az enzimhez való szoros kötődése stabilizálja, ezáltal csökkentve az aktiválás szükséges energiáját.

2.24.ábra
az enzim-szubsztrát kölcsönhatás modelljei. (A) A lock-and-key modellben a szubsztrát pontosan illeszkedik az enzim aktív helyére. B) az indukált illesztési modellben a szubsztrátkötés torzítja mind a szubsztrát, mind az enzim konformációit. Ez a torzítás (több…)
amellett, hogy több szubsztrátot hoz össze, és torzítja a szubsztrátok konformációját az átmeneti állapot megközelítéséhez, sok enzim közvetlenül részt vesz a katalitikus folyamatban. Ilyen esetekben az aktív helyen lévő specifikus aminosav-oldalláncok reakcióba léphetnek a szubsztráttal, és kötéseket képezhetnek a reakció közbenső termékeivel. A savas és bázikus aminosavak gyakran részt vesznek ezekben a katalitikus mechanizmusokban, amint azt a kimotripszin következő tárgyalása az enzimatikus katalízis példájaként szemlélteti.
a kimotripszin az enzimek (szerin proteázok) családjának tagja, amely a fehérjéket a peptidkötések hidrolízisének katalizálásával emészti fel. A reakció a következőképpen írható:

a szerin proteáz család különböző tagjai (beleértve a kimotripszint, a tripszint, az elasztázt és a trombint) különböző szubsztrát specifitással rendelkeznek; előnyben részesítik a különböző aminosavakkal szomszédos peptidkötéseket. Például, míg a kimotripszin a hidrofób aminosavak, például a triptofán és a fenilalanin melletti kötéseket emészti, addig a tripszin a bázikus aminosavak, például a lizin és az arginin melletti kötéseket emészti. Az összes szerin proteáz szerkezete azonban hasonló, és ugyanazt a katalízis mechanizmust használja. Ezeknek az enzimeknek az aktív helyei három kritikus aminosavat tartalmaznak-szerin, hisztidin és aszpartát -, amelyek a peptidkötés hidrolízisét hajtják végre. Valójában ezeket az enzimeket szerin proteázoknak nevezik a szerinmaradék központi szerepe miatt.
a szubsztrátok úgy kötődnek a szerin proteázokhoz, hogy a hasítási hely melletti aminosavat az enzim aktív helyén lévő zsebbe helyezik (2.25.ábra). Ennek a zsebnek a jellege határozza meg a szerin proteáz család különböző tagjainak szubsztrát-specifitását. Például a kimotripszin kötőzsebje hidrofób aminosavakat tartalmaz, amelyek kölcsönhatásba lépnek előnyös szubsztrátjainak hidrofób oldalláncaival. Ezzel szemben a tripszin kötő zseb negatív töltésű savas aminosavat (aszpartátot) tartalmaz, amely ionos kötést képes kialakítani szubsztrátjainak lizin-vagy argininmaradékaival.
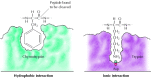
2.25.ábra
Szubsztrátkötés szerin proteázokkal. A hasítandó peptidkötéssel szomszédos aminosavat az enzim aktív helyén lévő zsebbe helyezzük. A kimotripszinben a zseb megköti a hidrofób aminosavakat; a tripszin kötő zsebében (több…)
a Szubsztrátkötés a hasítandó peptidkötést az aktív hely szerinje mellett helyezi el (2.26.ábra). Ennek a szerinnek a protonja ezután átkerül az aktív hisztidinbe. Az aktív hely konformációja kedvez ennek a protonátadásnak, mivel a hisztidin kölcsönhatásba lép a negatív töltésű aszpartát maradékkal. A szerin reagál a szubsztráttal, tetraéderes átmeneti állapotot képezve. A peptidkötést ezután hasítjuk, majd a szubsztrát C-terminális része felszabadul az enzimből. Az N-terminális peptid azonban továbbra is kötődik a szerinhez. Ez a helyzet akkor oldódik meg, amikor egy vízmolekula (a második szubsztrát) belép az aktív helyre, és megfordítja az előző reakciókat. A vízmolekula protonja hisztidinbe kerül, hidroxilcsoportja pedig a peptidbe kerül, második tetraéderes átmeneti állapotot képezve. A protont ezután a hisztidinből visszaviszik a szerinbe, majd a peptid felszabadul az enzimből, befejezve a reakciót.

ábra 2.26
a kimotripszin katalitikus mechanizmusa. Az aktív helyen található három aminosav (Ser-195, His-57 és Asp-102) kritikus szerepet játszik a katalízisben.
Ez a példa az enzimatikus katalízis számos jellemzőjét szemlélteti; az enzim-szubsztrát kölcsönhatások specifitását, a különböző szubsztrátmolekulák elhelyezkedését az aktív helyen, valamint az aktív hely maradékainak részvételét az átmeneti állapot kialakulásában és stabilizálásában. Bár a sejtekben lévő enzimek ezrei sokféle kémiai reakciót katalizálnak, működésükre ugyanazok az alapelvek vonatkoznak.