nos, fontolja meg az elektron sűrűségének delokalizációját. Ez az, amikor az elektronsűrűség a lehető legnagyobb mértékben eloszlik egy molekulában, így a minimális töltésfelhalmozódás jelen van egy adott pályán.
ezt írja le:
- együttesen a Lewis-struktúrák összes rezonancia-közreműködője.
- a molekuláris orbitális diagramok összes egyedi molekuláris orbitális hozzájárulása együttesen.
(ezek között finom különbségek vannak, de ezek az egyszerűség kedvéért nagyjából hasonlóak. További részletekért lásd itt.)
ennek hiánya az elektronsűrűség lokalizációja.
Ez az, amikor az összes elektronsűrűséget néhány pályára töltjük, ahelyett, hogy szétterítenénk, és ez szinte soha nem történik meg valódi molekulában vagy kvantumrendszerben (még akkor sem, ha nincs rezonancia).
példa rezonancia struktúrákkal
vegye figyelembe az izolált (nem reagáló) allil kationt, #”C”_3″H”_5^(+)#.
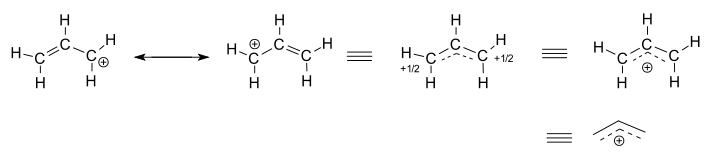
- a bal oldali két struktúra rezonancia közreműködő, amelyek mindegyike a valódi delokalizált szerkezet lokalizált ábrázolása.
- a három jobb oldali szerkezet a rezonancia hibrid szerkezet vagy a delokalizált szerkezet mindegyik ábrázolása.
a delokalizált szerkezetet alapvetően a kötő molekuláris pályák gyűjteménye írja le.
példa molekuláris orbitális diagrammal
tekintsük újra az allil kationt egy MO diagramban, amely csak a #bbpi# elektronokat írja le (azaz azokat az elektronokat, amelyek #pi# kötésben lennének egy lokalizált kettős kötésben!), de lehetővé teszi a reakciókban való részvételt:
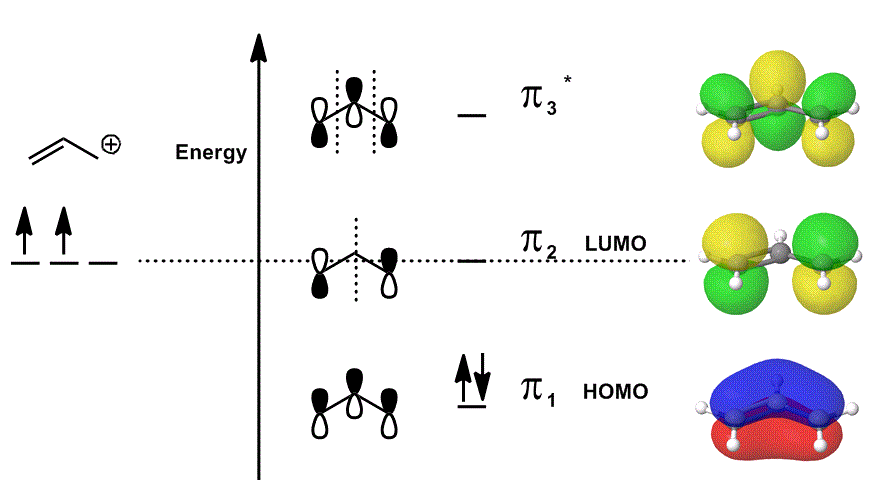
- a középső orbitális hozzájárulások mindegyike lokalizált; az átfedésben lévő atompályák önmagukként jelennek meg (a fázist is beleértve).
- A jobb szélső pályák mindegyike (soronként egy) delokalizálva van ábrázolva; az elektron sűrűsége megengedett, hogy szétterüljön, így a molekuláris pályák az átfedések, csomópontok és fázisok teljes figyelembevételével vannak ábrázolva.
amikor átfedjük a #pi_1#, #pi_2 # és # pi_3^”* ” # állapotokat, és beépítjük ezeknek az állapotoknak a súlyozott hozzájárulását (a #c_i # együtthatók szerint súlyozva), megkapjuk a molekuláris pályák lineáris kombinációját:
#Psi_(“allil”^(+)) = c_1overbrace(pi_1)^”kötés” + c_2overbrace(pi_2)^”nonbonding” + c_3overbrace(pi_3^”*”)^”antibonding”#
és #Psi_(“allil”^(+))# akkor leírja az allil-kation reaktivitását együttesen leíró állapotok általános eloszlását.
más szavakkal: #pi_1# (amely #pi# elektronokat adományoz a kötéshez), #pi_2# (amely elfogadja az elektronokat a kötéshez), és #pi_3^”* ” # (ebben az esetben ritkán vesz részt) mind csinálnak valamit, amikor az allil kation részt vesz egy kémiai reakcióban, mert (ha foglalt), egyszerre léteznek.