egy jó kiindulási pont, amikor meg kell találni egy ion elektronkonfigurációját, a semleges atom elektronkonfigurációja.
az Ön esetében meg kell találnia a fluorid anion elektronkonfigurációját, #”F”^(-)#, tehát kezdje Egy semleges fluor atom elektronkonfigurációjának megírásával, #”F”#.
a fluor a periódusos rendszer 2.periódusában, 17. csoportjában található, atomszáma #9#. Ez azt mondja, hogy a semleges fluor atomnak összesen # 9 # elektronja van a magjában.
elektronkonfigurációja
#”F:” 1s^2 2s^2 2p^5#
most az #”F”^(-)# anion keletkezik, amikor #1# elektront adunk egy semleges fluor atomhoz.
figyeljük meg ,hogy a 2p-alhéj a semleges atom tartalmaz # 5 # elektronok. Maximális kapacitása valójában # 6 # elektron, két elektron minden p-orbitális számára.
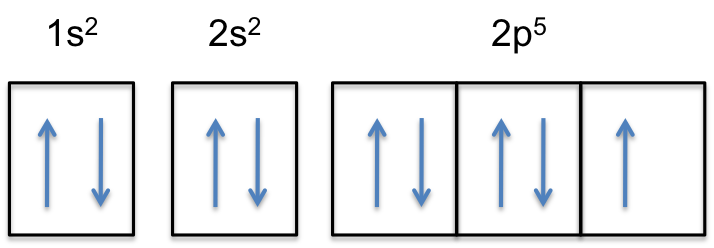
Ez azt jelenti, hogy a # szín (piros) (“extra elektron”)# hozzáadódik a három 2P-pálya egyikéhez, mondjuk a #2p_y# – hez.
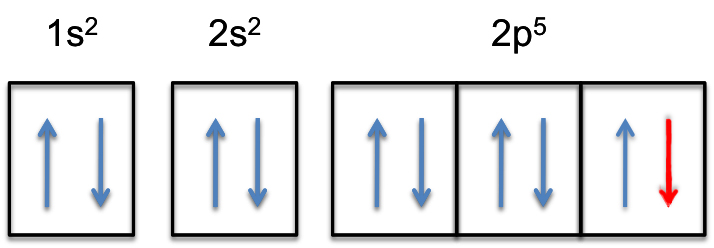
a 2p-alhéj most teljesen meg lesz töltve, azaz #6# elektronokat fog tartani.
a fluorid anion elektronkonfigurációja tehát
#Szín(Zöld)(|bar(ul(Szín(Fehér)(A/a)szín(fekete) (“F”^( -):szín(fehér) (a) 1s^2color(fehér) (a) 2s^2 color(fehér) (a)2p^6)color(fehér) (a/a)|))#
figyeljük meg, hogy a fluorid anion összesen #8# elektronok a második héj, a legkülső héj. Ez azt mondja, hogy az anionnak teljes oktettje van.
mivel a fluorid anion izoelektronikus neonnal, #”Ne”#, az elektronkonfigurációját a nemesgáz rövidítéssel írhatja
#”f”^(-): #
itt
## – a neon elektronkonfigurációja
# / p >