Catherine Gara
január 2016-nyálka nem lehet valami, amit szeretnék gondolni, de életünk függ tőle. Cisztás fibrózisban (CF) a nyálka megvastagodása tüdőfertőzésekhez és bélblokkokhoz vezet, többek között a tünetek mellett. A betegséget egyetlen gén okozza, amelyet a rendellenességet okozó több mint 1700 mutáció közül egy vagy több befolyásol. A Johns Hopkinsnál a kutatók és a klinikus genetikusok együtt dolgoznak, hogy mindent megtudjanak a génről, a fehérjéről és arról, hogy mi történik rosszul a betegekben, tudva, hogy minden információ, amelyet megszereznek, közelebb hozza őket ahhoz, hogy minden CF-ben szenvedő egyén számára kezelési lehetőségeket kapjanak.
Add nekem a sót
manapság a CF-ben szenvedő betegek sokkal jobban járnak a gyakori tüdőfertőzéseket kezelő kezeléseknek köszönhetően, de a CF diagnózisa még mindig csak 38 várható élettartamot jelent a hasnyálmirigy, a máj és a belek miatt. A baj a cisztás fibrózis transzmembrán vezetőképesség-szabályozó (CFTR) gén hibáiból származik, amely a CFTR fehérje tervét hordozza. A CFTR fehérje olyan, mint a bejárati ajtó e-mail nyílása. Kis átjárót képez a sejt belseje és kívül.
megfelelő működés esetén a CFTR segít szabályozni a kloridionok (a só egyik alkotóeleme) átjutását a sejtbe és a sejtből. A tüdőben és a hasnyálmirigy csatornáiban, amikor a klorid elhagyja a sejteket, arra ösztönzi a vizet, hogy kövesse. Ez a víz segít vékony nyálkahártyák kialakításában. A tüdőben a nyálka csapdába ejti a port és a baktériumokat, amelyeknek nem kellene ott lenniük. A csillók, vagy hajszerű struktúrák, a sejtek, hogy a vonal a tüdő, majd pásztor a nyálka fel a légutakat a száj, ahol ez lesz lenyelni, és küldött, hogy megemészteni. A hasnyálmirigyben a folyadék segít enzimeket szállítani a bélbe, hogy elősegítse az élelmiszer-emésztést. Ha a nyálka túl viszkózus a tüdőben, a csillók nem tudják mozgatni, így a baktériumok ott maradnak, hogy fertőzést okozzanak; ha túl viszkózus a hasnyálmirigy-csatornákban, az enzimek nem jutnak el a bélbe, és az étel nem emészthető megfelelően.
a fehérje útja
Garry Cutting, a genetikai Orvostudományi Intézet professzora és Bill Guggino, a fiziológiai Tanszék igazgatója karrierjük nagy részében tanulmányozták a CFTR gént és annak kódolt fehérjéjét. Cutting érdeklődése abból fakad, hogy egy testvérpár CF-vel gondoskodik, miközben a Johns Hopkins rezidense. Guggino érdeklődése még messzebbre nyúlik vissza-a gyermekkori tengeri kirándulásokra. Kíváncsi volt, hogy a halak hogyan élhetnek túl sós vízben, és megtudta, hogy a rövid válasz: a CFTR verziójuk.
Ha nehéz elképzelni, hogy egy egész karrier egyetlen génre és annak fehérjetermékére összpontosítson, gondoljon rá úgy, mint egy összetett Rubik-kockára, amely 1480 mágneses blokkból (aminosavakból) álló láncból áll. A CFTR gén mutációja gyakran az egyik aminosav változását jelenti, amely drámai módon befolyásolhatja a végső háromdimenziós formát.
egyes mutációk miatt a fehérje nem keletkezik. Mások lehetővé teszik a részleges fehérje szintetizálását. Minél közelebb vannak a fehérje kezdetéhez ezek a mutációk, annál rosszabb a funkciója. Más mutációk csak rossz helyen fordulnak elő, és megakadályozzák például a sócsatorna megnyitását. Megint mások nem megfelelően hajtják végre a CFTR-t, ami jelzi a cella minőségellenőrző csapatának, hogy vegye fel és újrahasznosítsa. Mások nem zavarják a fehérje működését, de megakadályozzák, hogy eljusson a plazmamembránhoz, ahol a munkáját végzi.
Cutting és Guggino erőfeszítései hozzájárultak két CF gyógyszer tervezéséhez a piacon: ivacaftor és lumacaftor. Az ivakaftor aktiválja a G551D mutációt hordozó CFTR-t. Cutting laboratóriuma először 1990-ben számolt be erről a mutációról, és Guggino és Cutting később új betekintést nyert a mutáció hatására a CFTR funkcióra és a betegek tüneteire. Sajnos a G551D mutáció csak a CF-ben szenvedő betegek 4% – ában található meg. Kiderült azonban, hogy a CF-ben szenvedő betegek 50% – ánál van egy másik mutáció két példánya (az úgynevezett delta F508), ami miatt a CFTR rosszul képződik és a sejt újrahasznosító tartályába kerül. A lumakaftor megakadályozza annak újrahasznosítását, így eljut a plazmamembránhoz. Ezután az ivacaftor megadja neki a működéshez szükséges” rúgást”.
“a delta F508 CFTR még mindig fogyatékos, de jobb, mint a semmi” – mondja Guggino. “Ez azt jelenti, hogy már nem csak a tüneteket kezeljük. A kiváltó okokat kezeljük.”
nem maradt gyermek
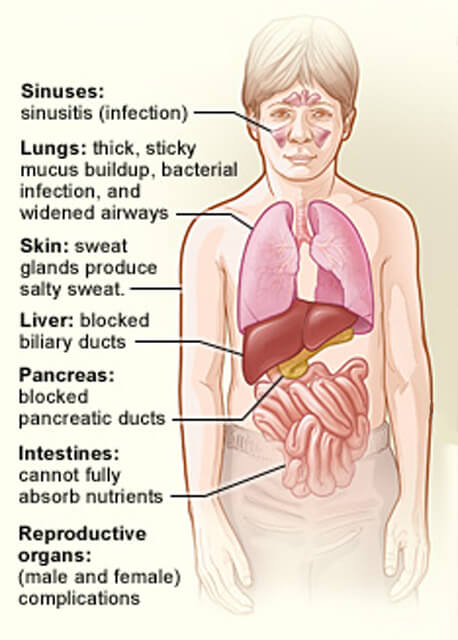 a cisztás fibrózis által érintett szervek.
a cisztás fibrózis által érintett szervek.Credit: National Heart, Lung and Blood Institute
a CF — ben szenvedő betegek több mint 40 százaléka más mutációkkal — néhány meglehetősen ritka-nem mindig olyan szerencsés. A CFTR génben több mint 1700 olyan mutáció van, amely CF-et okoz, és csak egy kisebb frakciót teszteltek a jóváhagyott gyógyszerekre adott válaszra. A teszteltek egy része reagál az egyik vagy a másik gyógyszerre, de mások nem. mégis, a kutatók remélik, hogy egy nap képesek lesznek mindenkinek segíteni. A vágás azt tervezi, hogy végül az egyes betegeket theratype szerint kategorizálja, egy szó, amelyet olyan betegcsoportok leírására hozott létre, akik valószínűleg ugyanazon terápiára reagálnak tüneteik közös oka miatt. Szorosan együttműködik Patrick Sosnay és Karen Raraigh kollégákkal, hogy világszerte 88 000 ember adatait elemezzék, hogy teszteljék koncepcióját.
a sejtekben végzett kísérletek által generált információkat felhasználhatjuk olyan mutációk csoportosítására, amelyek befolyásolják a CFTR ugyanazon tulajdonságát, ezért a CFTR gyógyszerek ugyanazon paneljére kell reagálniuk. A mutációk teratípus szerinti csoportosítása lehetővé tenné a különböző mutációkat hordozó betegeken végzett klinikai vizsgálatokat, ahelyett, hogy olyan klinikai vizsgálatokat végeznének, amelyek egyszerre egy mutációt értékelnének” – mondja Cutting. “Ez a precíziós orvoslás valósággá válik.”
sajnos a kábítószer-alapú terápiák nem fognak működni minden CF-ben szenvedő betegnél, különösen a 2% – nál, akik egyáltalán nem termelnek CFTR-t. Ezekre a kutatók kidolgozzák a mutált gén megcélzásának módjait, bár még mindig sok akadályt kell leküzdeni.
Guggino kifejlesztett egy génterápiás rendszert, amely módosított adeno-asszociált vírust (AAV) használ a CFTR gén jó változatának a sejtekbe történő elhelyezésére. A rendszer bebizonyította magát az emberi légúti sejtekben és rágcsálókban.
egy másik megközelítést kipróbálva Liudmila Cebotaru, az Orvostudományi Minisztérium új módszert dolgozott ki a génterápia és a fehérje-javítás kombinálására egy transzkomplementációnak nevezett mechanizmussal. Ahelyett, hogy a teljes hosszúságú CFTR gént az AAV-ba helyezné, rövidebb változatot használ, amely könnyebben beilleszthető a sejt genomjába. Amikor a rövidebb fehérje termelődik, kötődik a beteg mutáns fehérjéjéhez, és segít eljutni a plazmamembránhoz. Mind Cebotaru, mind Guggino most teszteli új megközelítését rhesus majmokon, mivel tüdejük és immunrendszerük nagyon közel áll az emberekhez. Remélik, hogy a következő években klinikai vizsgálatot indítanak, ha minden jól megy.
“szeretek úgy gondolni rá, mint az autó akkumulátorának ugrására” – mondja. “Egy kis extra segítséggel a betegek CFTR fehérjéi eljuthatnak rendeltetési helyükre.”
mind a kutatók, mind a betegek számára a cél nem kevesebb, mint a CF gyógyítása. És bár ez még messze van, vannak biztató jelek arra, hogy eljuthatunk oda.