Curve di riscaldamento
Figura \(\PageIndex{3}\) mostra una curva di riscaldamento, un grafico della temperatura rispetto al tempo di riscaldamento, per un campione di 75 g di acqua. Il campione è inizialmente ghiaccio a 1 atm e -23°C; con l’aggiunta di calore, la temperatura del ghiaccio aumenta linearmente con il tempo. La pendenza della linea dipende sia dalla massa del ghiaccio che dal calore specifico (Cs) del ghiaccio, che è il numero di joule necessari per aumentare la temperatura di 1 g di ghiaccio di 1°C. All’aumentare della temperatura del ghiaccio, le molecole d’acqua nel cristallo di ghiaccio assorbono sempre più energia e vibrano più vigorosamente. Al punto di fusione, hanno abbastanza energia cinetica per superare le forze attraenti e muoversi l’uno rispetto all’altro. Con l’aggiunta di più calore, la temperatura del sistema non aumenta ulteriormente ma rimane costante a 0°C fino a quando tutto il ghiaccio non si è sciolto. Una volta che tutto il ghiaccio è stato convertito in acqua liquida, la temperatura dell’acqua ricomincia ad aumentare. Ora, tuttavia, la temperatura aumenta più lentamente di prima perché la capacità termica specifica dell’acqua è maggiore di quella del ghiaccio. Quando la temperatura dell’acqua raggiunge i 100°C, l’acqua inizia a bollire. Anche qui, la temperatura rimane costante a 100°C fino a quando tutta l’acqua è stata convertita in vapore. A questo punto, la temperatura inizia nuovamente a salire, ma ad un ritmo più veloce rispetto a quanto visto nelle altre fasi perché la capacità termica del vapore è inferiore a quella del ghiaccio o dell’acqua.
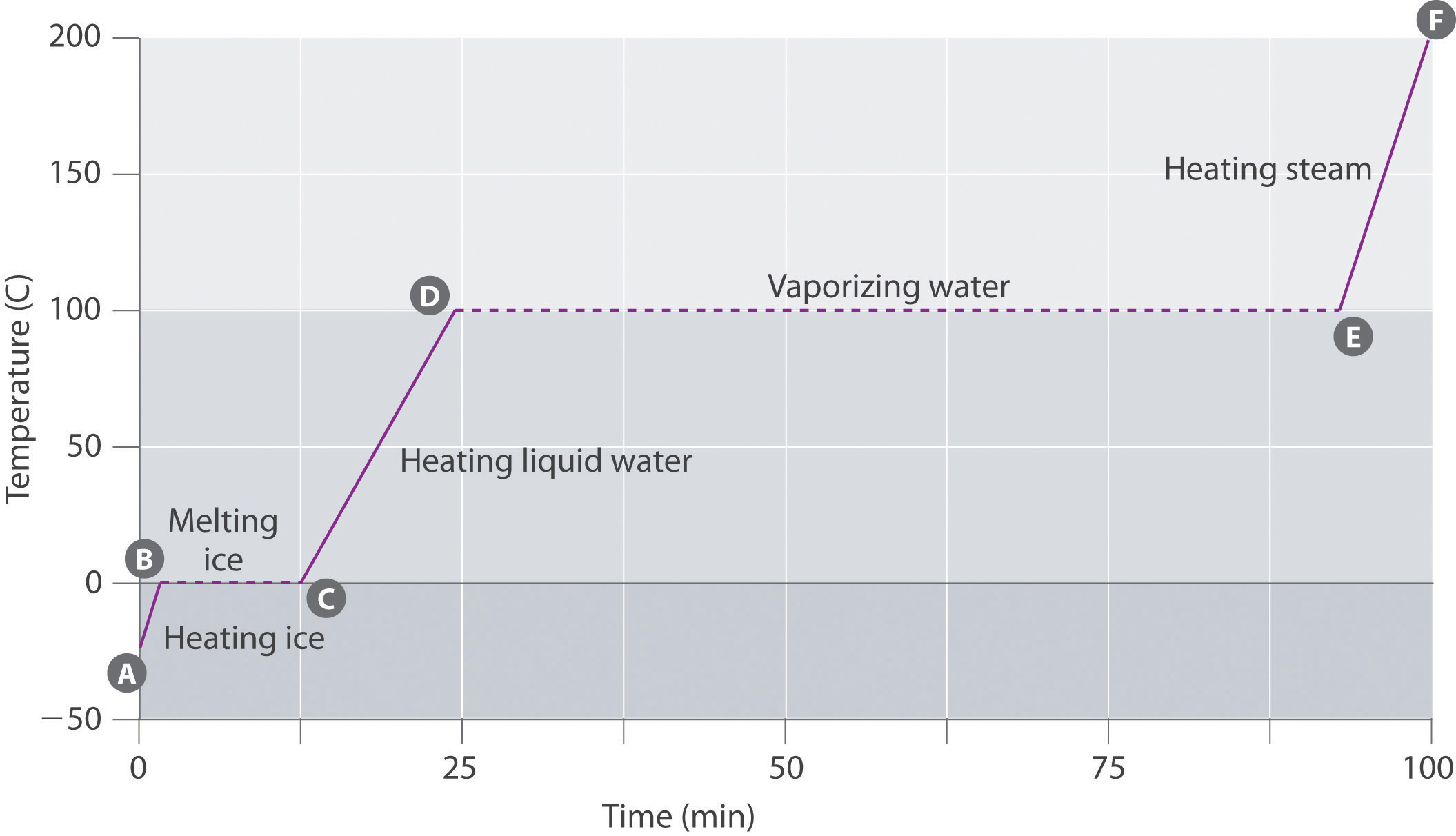
Quindi la temperatura di un sistema non cambia durante un cambiamento di fase. In questo esempio, finché anche una piccola quantità di ghiaccio è presente, la temperatura del sistema rimane a 0°C durante il processo di fusione, e finché anche una piccola quantità di acqua liquida è presente, la temperatura del sistema rimane a 100°C durante il processo di ebollizione. La velocità con cui viene aggiunto calore non influisce sulla temperatura della miscela ghiaccio/acqua o acqua/vapore perché il calore aggiunto viene utilizzato esclusivamente per superare le forze attrattive che tengono insieme la fase più condensata. Molti cuochi pensano che il cibo cucinerà più velocemente se il calore viene alzato più in alto in modo che l’acqua bolle più rapidamente. Invece, la pentola d’acqua bollirà a secco prima, ma la temperatura dell’acqua non dipende da quanto vigorosamente bolle.
La temperatura di un campione non cambia durante un cambiamento di fase.
Se il calore viene aggiunto a una velocità costante, come nella figura \(\PageIndex{3}\), la lunghezza delle linee orizzontali, che rappresenta il tempo durante il quale la temperatura non cambia, è direttamente proporzionale alla grandezza delle entalpie associate ai cambiamenti di fase. Nella figura \ (\PageIndex{3}\), la linea orizzontale a 100°C è molto più lunga della linea a 0°C perché l’entalpia di vaporizzazione dell’acqua è parecchie volte maggiore dell’entalpia di fusione.
Un liquido surriscaldato è un campione di un liquido alla temperatura e alla pressione alla quale dovrebbe essere un gas. I liquidi surriscaldati non sono stabili; il liquido finirà per bollire, a volte violentemente. Il fenomeno del surriscaldamento provoca “urti” quando un liquido viene riscaldato in laboratorio. Quando una provetta contenente acqua viene riscaldata su un bruciatore Bunsen, ad esempio, una porzione del liquido può facilmente diventare troppo calda. Quando il liquido surriscaldato si converte in un gas, può spingere o “urtare” il resto del liquido fuori dalla provetta. Posizionare un’asta di agitazione o un piccolo pezzo di ceramica (un “chip bollente”) nella provetta consente di formare bolle di vapore sulla superficie dell’oggetto in modo che il liquido bolle invece di surriscaldarsi. Il surriscaldamento è la ragione per cui un liquido riscaldato in una tazza liscia in un forno a microonde potrebbe non bollire fino a quando la tazza non viene spostata, quando il movimento della tazza consente la formazione di bolle.