Punto di ebollizione
Quando un liquido viene riscaldato, l’energia cinetica media delle sue particelle aumenta. Il tasso di evaporazione aumenta man mano che sempre più molecole sono in grado di sfuggire alla superficie del liquido nella fase vapore. Alla fine si raggiunge un punto in cui le molecole in tutto il liquido hanno abbastanza energia cinetica per vaporizzare. A questo punto il liquido inizia a bollire. Il punto di ebollizione è la temperatura alla quale la pressione di vapore di un liquido è uguale alla pressione esterna. La figura seguente illustra l’ebollizione del liquido.
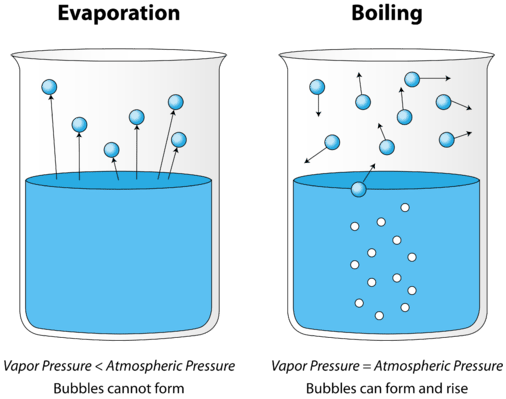
Nell’immagine a sinistra, il liquido è al di sotto del suo punto di ebollizione, ma parte del liquido evapora. A destra, la temperatura è stata aumentata fino a quando le bolle iniziano a formarsi nel corpo del liquido. Quando la pressione di vapore all’interno della bolla è uguale alla pressione atmosferica esterna, le bolle salgono sulla superficie del liquido e scoppiano. La temperatura alla quale si verifica questo processo è il punto di ebollizione del liquido.
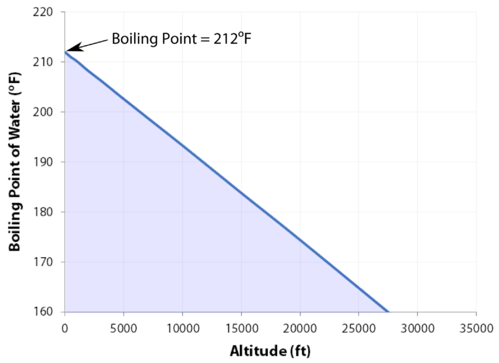
Il normale punto di ebollizione è la temperatura alla quale la pressione di vapore del liquido è uguale alla pressione standard. Poiché la pressione atmosferica può cambiare in base alla posizione, il punto di ebollizione di un liquido cambia con la pressione esterna. Il punto di ebollizione normale è una costante perché è definito rispetto alla pressione atmosferica standard di \(760\: \ text {mm}\: \ ce {Hg}\) (o \ (1\:\ text{atm}\) o \ (101.3\:\text{kPa}\)).