Le reazioni redox riguardano il trasferimento di elettroni da una sostanza all’altra, quindi è utile avere un sistema per tenere traccia di ciò che guadagna e ciò che perde elettroni e quanti elettroni sono coinvolti. Il sistema di registrazione per le reazioni redox è chiamato Numeri di ossidazione. Si può anche ricordare qualcosa chiamato elettronegatività da precedenti classi di chimica.
Elettronegatività
La capacità di un atomo legato di attrarre elettroni condivisi verso se stesso.
Quando due atomi di elementi diversi sono legati insieme da un legame covalente (condivisione di elettroni), gli elettroni non sono generalmente condivisi equamente tra i due atomi a causa delle differenze nelle loro elettronegatività. Pensate a questo come un tiro alla fune per gli elettroni. A volte entrambi gli atomi tirano con uguale forza su elettroni condivisi; altre volte c’è chiaramente un giocatore più forte che tirerà gli elettroni più vicini a se stesso.
Considera il legame tra un atomo di idrogeno (con un elettrone di valenza) e un atomo di ossigeno (con i suoi sei elettroni di valenza):
|
|
+
|
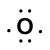 |
=
|
 |
Because oxygen has a higher electronegativity than hydrogen, the shared electrons are closer to the oxygen atom than to l’atomo di idrogeno. Questo non è il trasferimento totale di elettroni che creerebbe uno ion, ma si formano cariche parziali. L’estremità dell’idrogeno del legame è parzialmente positiva (+1) perché ha parzialmente perso un elettrone e l’estremità dell’ossigeno dell’H-O è parzialmente negativa (-1) perché ha parzialmente guadagnato un elettrone dall’idrogeno:
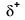 |
|
 |
|
Our molecule is incomplete, however, because there is a lone electron around oxygen. Let’s add one more hydrogen to complete our water molecule:
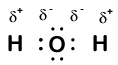
Vediamo che ciascuno dei due idrogeni ha “perso” un elettrone in ossigeno. L’ossigeno ha “guadagnato” due elettroni—uno da ciascun idrogeno. Ancora una volta, questi non sono veri ioni, ma è utile pensarli allo stesso modo.
Le cariche date agli atomi in una molecola in questo modo sono chiamate numeri di ossidazione. Possiamo usare i numeri di ossidazione per tenere traccia di dove si trovano gli elettroni in una molecola e di come si muovono durante una reazione. Nel nostro esempio di acqua, all’idrogeno viene assegnato un numero di ossidazione di +1 perché ogni singolo idrogeno ha “perso” un elettrone. L’ossigeno ha un numero di ossidazione di +2 perché il singolo atomo di ossigeno ha “guadagnato” un totale di due elettroni, uno da ciascun idrogeno.
Ecco un’altra molecola che coinvolgono idrogeno e ossigeno, perossido di idrogeno, H2O2:
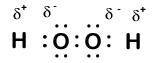
il perossido di idrogeno, ogni idrogeno ha ancora un numero di ossidazione +1, perché ogni idrogeno “dà” un singolo elettrone all’ossigeno. L’ossigeno, tuttavia, ora ha un numero di ossidazione di -1 perché ogni ossigeno guadagna solo un elettrone dal suo idrogeno vicino. Gli elettroni tra i due atomi di ossigeno identici sono condivisi equamente, quindi non vi è alcuna carica parziale risultante da quel legame.
Numero di ossidazione
Un numero positivo o negativo assegnato ad un atomo in una molecola o ion che riflette un guadagno parziale o perdita di elettroni.
Conoscere il numero di ossidazione di ogni singolo elemento in una molecola sarà un passo chiave nella nostra comprensione delle reazioni redox. Fortunatamente di solito non coinvolgerà il disegno di diagrammi di punti elettronici. Invece, ci sono una serie di regole che possiamo usare per determinare i numeri di ossidazione. Ecco le regole principali:
| Il numero di ossidazione di un elemento puro (da solo, e non uno ion) è zero. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
The oxidation number of a monatomic ion (by itself or as part of an ionic compound) is equal a suo carico. I metalli alcalini-elementi nella prima colonna della tavola periodica-avranno sempre un numero di ossidazione di +1; I metalli alcalino terrosi (colonna 2) sono quasi sempre +2. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The oxidation number of hydrogen is almost always +1 when it is in a compound. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Il numero di ossidazione dell’ossigeno è quasi sempre -2 quando è in un composto. Le eccezioni:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La somma dei numeri di ossidazione in un composto è uguale a zero. Per determinare il numero di ossidazione di Mn in Mn2O7, dobbiamo lavorare all’indietro:
-2 × 7 atomi = -14 totale Poiché la somma dei numeri di ossidazione deve essere zero, il numero di ossidazione totale di Mn deve essere +14 per annullare l’ossigeno -14, ma poiché ci sono 2 atomi di Mn, ogni singolo atomo avrà un numero di ossidazione di +7:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La somma dei numeri di ossidazione in uno ion poliatomico è uguale alla carica su quello ion. Ancora una volta, lavorare all’indietro per determinare il numero di ossidazione di qualsiasi atomo non ossigeno o non idrogeno. determinare il numero di ossidazione del Cr in Cr2O72- :
-2 × 7 = -14
+12 + (-14) = -2
= +7
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
It is importante notare che il numero di ossidazione si riferisce sempre ad ogni singolo atomo nel composto, non al totale per quell’elemento.
Ad esempio, in H2O, la “carica” positiva totale per entrambi gli atomi di idrogeno sarà +2 (che si equilibra con il -2 dell’ossigeno), ma ogni idrogeno ha un numero di ossidazione di +1.
Contributi & Attribuzioni
Questa pagina è stata costruita a partire dal contenuto tramite i seguenti contributori e modificata (localmente o estesamente) dal team di sviluppo LibreTexts per soddisfare lo stile, la presentazione e la qualità della piattaforma:
-
Fondazione CK-12 di Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson e Jean Dupon.