Obiettivi di Apprendimento
- Utilizzare cella notazione per descrivere celle galvaniche
- Descrivere i componenti di base di celle galvaniche\
celle Galvaniche, noto anche come voltaico cellule, sono le celle elettrochimiche in cui spontanee di reazioni di ossido-riduzione la produzione di energia elettrica. Nello scrivere le equazioni, è spesso conveniente separare le reazioni di riduzione dell’ossidazione in semireazioni per facilitare il bilanciamento dell’equazione complessiva e per enfatizzare le trasformazioni chimiche effettive.
Considera cosa succede quando un pezzo pulito di metallo di rame viene posto in una soluzione di nitrato d’argento (Figura \(\PageIndex{1}\)). Non appena viene aggiunto il metallo di rame, il metallo d’argento inizia a formarsi e gli ioni di rame passano nella soluzione. Il colore blu della soluzione all’estrema destra indica la presenza di ioni di rame. La reazione può essere divisa nelle sue due mezze reazioni. Le mezze reazioni separano l’ossidazione dalla riduzione, quindi ciascuna può essere considerata individualmente.
L’equazione per la semireazione di riduzione doveva essere raddoppiata in modo che il numero di elettroni “guadagnati” nella semireazione di riduzione equivalesse al numero di elettroni “persi” nella semireazione di ossidazione.

Le celle galvaniche o voltaiche comportano reazioni elettrochimiche spontanee in cui le semireazioni sono separate (Figura \(\PageIndex{2}\)) in modo che la corrente possa fluire attraverso un filo esterno. Il becher sul lato sinistro della figura è chiamato mezza cella e contiene una soluzione di 1 M di nitrato di rame(II) con un pezzo di metallo di rame parzialmente immerso nella soluzione. Il metallo di rame è un elettrodo. Il rame sta subendo l’ossidazione; quindi, l’elettrodo di rame è l’anodo. L’anodo è collegato a un voltmetro con un filo e l’altro terminale del voltmetro è collegato a un elettrodo d’argento da un filo. L’argento è in fase di riduzione; pertanto, l’elettrodo d’argento è il catodo. La mezza cella sul lato destro della figura è costituita dall’elettrodo d’argento in una soluzione di nitrato d’argento 1 M (AgNO3). A questo punto, nessuna corrente scorre—cioè, nessun movimento significativo di elettroni attraverso il filo si verifica perché il circuito è aperto. Il circuito è chiuso usando un ponte di sale, che trasmette la corrente con ioni in movimento. Il ponte salino è costituito da una soluzione elettrolitica concentrata, non reattiva, come la soluzione di nitrato di sodio (NaNO3) utilizzata in questo esempio. Mentre gli elettroni fluiscono da sinistra a destra attraverso l’elettrodo e il filo, gli ioni nitrati(anioni) passano attraverso il tappo poroso a sinistra nella soluzione di nitrato di rame (II). Ciò mantiene il becher a sinistra elettricamente neutro neutralizzando la carica sugli ioni di rame(II) che vengono prodotti nella soluzione quando il metallo di rame viene ossidato. Allo stesso tempo, gli ioni nitrati si muovono a sinistra, gli ioni sodio (cationi) si muovono a destra, attraverso il tappo poroso e nella soluzione di nitrato d’argento a destra. Questi cationi aggiunti “sostituiscono” gli ioni d’argento che vengono rimossi dalla soluzione quando sono stati ridotti a metallo argentato, mantenendo il becher sulla destra elettricamente neutro. Senza il ponte di sale, i compartimenti non rimarrebbero elettricamente neutri e nessuna corrente significativa scorrerebbe. Tuttavia, se i due compartimenti sono in contatto diretto, non è necessario un ponte di sale. L’istante in cui il circuito è completato, il voltmetro legge + 0,46 V, questo è chiamato potenziale di cella. Il potenziale cellulare viene creato quando i due metalli dissimili sono collegati ed è una misura dell’energia per unità di carica disponibile dalla reazione di riduzione dell’ossidazione. Il volt è l’unità SI derivata per il potenziale elettrico
\
In questa equazione, A è la corrente in ampere e C la carica in coulombs. Si noti che i volt devono essere moltiplicati per la carica in coulombs (C) per ottenere l’energia in joule (J).
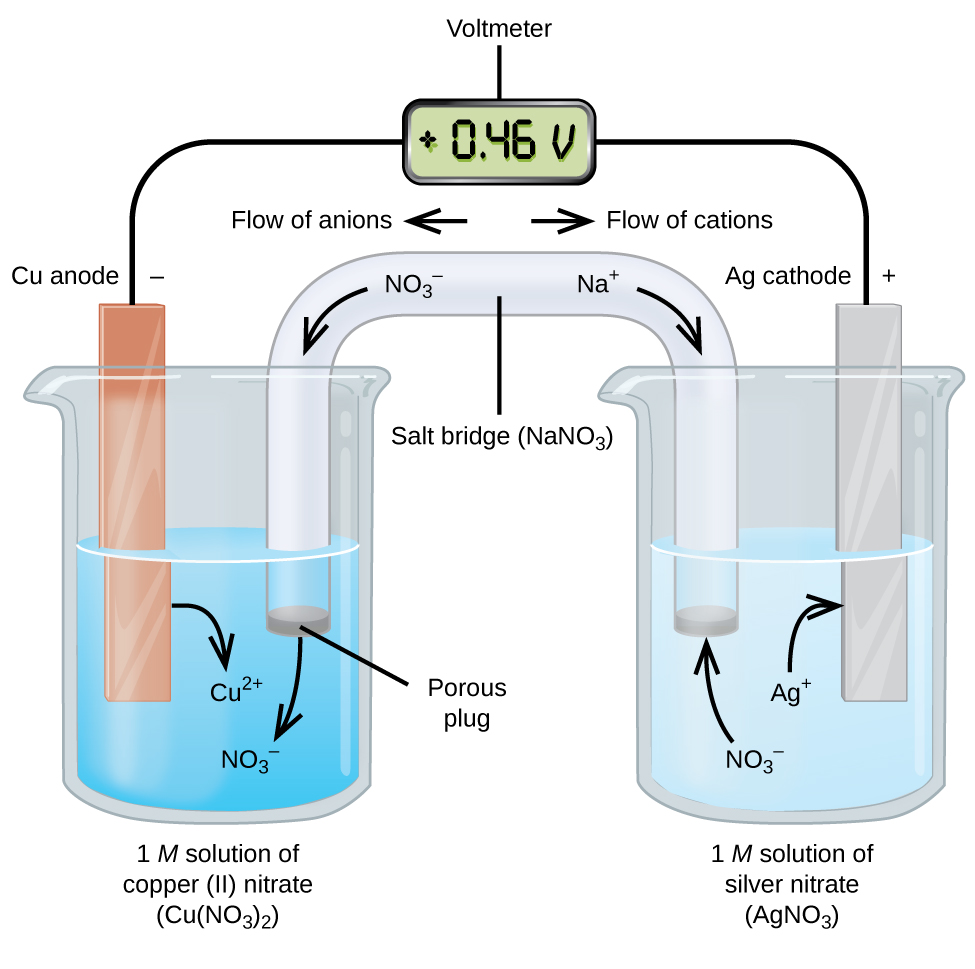
Quando la cella elettrochimica è costruita in questo modo, un potenziale di cella positivo indica una reazione spontanea e che gli elettroni scorrono da sinistra a destra. C’è molto da fare nella figura \ (\PageIndex{2}\), quindi è utile riassumere le cose per questo sistema:
- Gli elettroni fluiscono dall’anodo al catodo: da sinistra a destra nella cella galvanica standard nella figura.
- L’elettrodo nella semi-cella sinistra è l’anodo perché l’ossidazione si verifica qui. Il nome si riferisce al flusso di anioni nel ponte di sale verso di esso.
- L’elettrodo nella metà cella destra è il catodo perché la riduzione avviene qui. Il nome si riferisce al flusso di cationi nel ponte di sale verso di esso.
- L’ossidazione avviene all’anodo (la mezza cella sinistra nella figura).
- La riduzione avviene al catodo (la mezza cella destra nella figura).
- Il potenziale di cella ,+ 0,46 V, in questo caso, deriva dalle differenze intrinseche nella natura dei materiali utilizzati per realizzare le due mezze celle.
- Il ponte di sale deve essere presente per chiudere (completare) il circuito e devono verificarsi sia un’ossidazione che una riduzione per il flusso di corrente.
Ci sono molte celle galvaniche possibili, quindi una notazione abbreviata viene solitamente utilizzata per descriverle. La notazione cellulare (a volte chiamata diagramma cellulare) fornisce informazioni sulle varie specie coinvolte nella reazione. Questa notazione funziona anche per altri tipi di celle. Una linea verticale,│, denota un confine di fase e una doppia linea,‖, il ponte di sale. Le informazioni sull’anodo sono scritte a sinistra, seguite dalla soluzione di anodo, quindi dal ponte di sale (quando presente), quindi dalla soluzione di catodo e, infine, dalle informazioni sul catodo a destra. La notazione della cella per la cella galvanica in Figura \ (\PageIndex{2}\) è quindi
\
Si noti che gli ioni spettatore non sono inclusi e che è stata utilizzata la forma più semplice di ogni semireazione. Quando noto, le concentrazioni iniziali dei vari ioni sono solitamente inclusi.
Una delle cellule più semplici è la cellula di Daniell. È possibile costruire questa batteria posizionando un elettrodo di rame sul fondo di un barattolo e coprendo il metallo con una soluzione di solfato di rame. Una soluzione di solfato di zinco viene fatta galleggiare sopra la soluzione di solfato di rame; quindi un elettrodo di zinco viene posto nella soluzione di solfato di zinco. Il collegamento dell’elettrodo di rame all’elettrodo di zinco consente il flusso di una corrente elettrica. Questo è un esempio di una cella senza un ponte di sale, e gli ioni possono fluire attraverso l’interfaccia tra le due soluzioni.
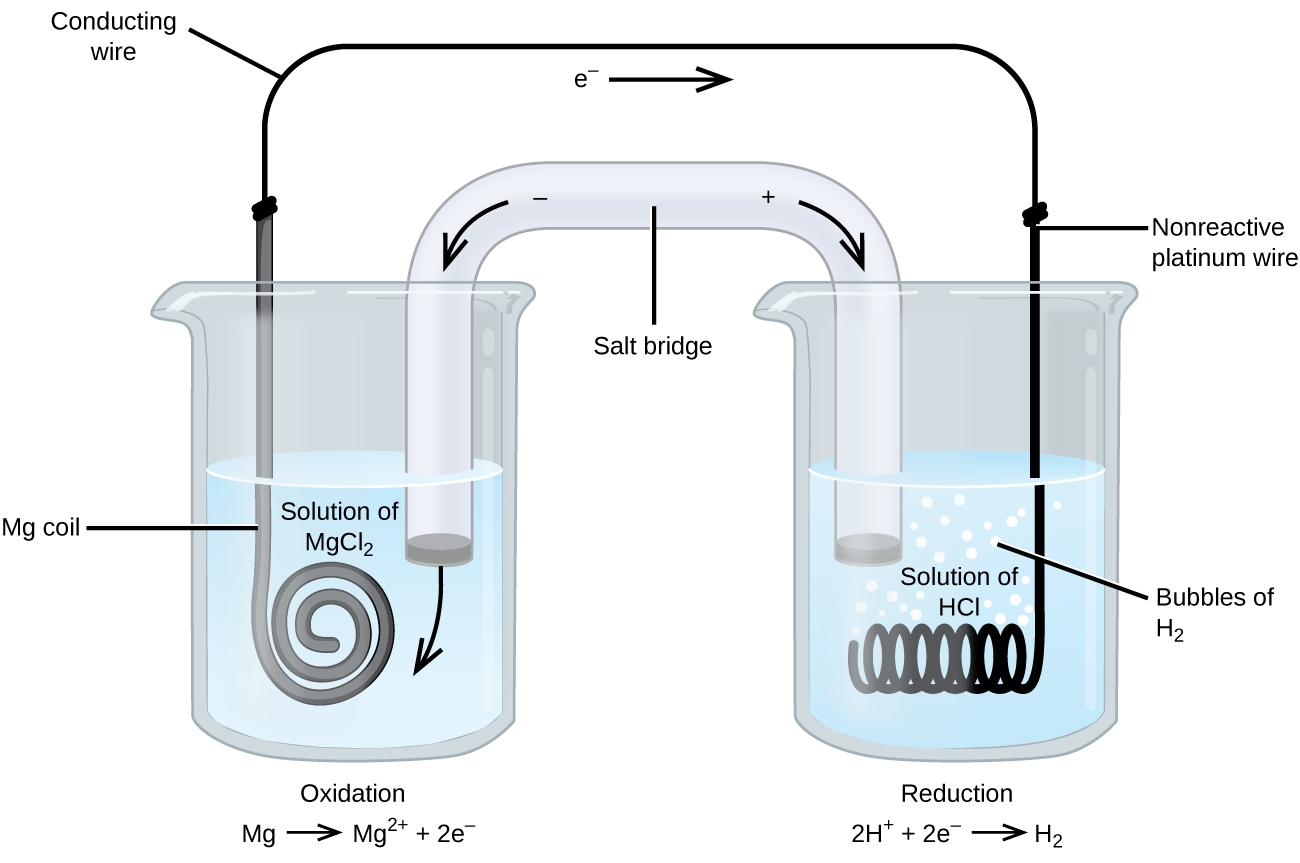
Alcune reazioni di riduzione dell’ossidazione coinvolgono specie che sono poveri conduttori di elettricità, e quindi viene utilizzato un elettrodo che non partecipa alle reazioni. Frequentemente, l’elettrodo è platino, oro o grafite, che sono tutti inerti a molte reazioni chimiche. Uno di questi sistemi è mostrato in Figura \(\PageIndex{3}\). Il magnesio subisce ossidazione all’anodo a sinistra nella figura e gli ioni idrogeno subiscono una riduzione al catodo a destra. La reazione può essere riassunta come
La cella ha usato un filo di platino inerte per il catodo, quindi la notazione della cella è
L’elettrodo di magnesio è un elettrodo attivo perché partecipa alla reazione di riduzione dell’ossidazione. Gli elettrodi inerti, come l’elettrodo di platino in Figura \(\PageIndex{3}\), non partecipano alla reazione di riduzione dell’ossidazione e sono presenti in modo che la corrente possa fluire attraverso la cella. Il platino o l’oro generalmente fanno buoni elettrodi inerti perché sono chimicamente non reattivi.
Esempio \(\PageIndex{1}\): Usando la notazione cellulare
Considera una cella galvanica composta da
\
Scrivi le mezze reazioni di ossidazione e riduzione e scrivi la reazione usando la notazione cellulare. Quale reazione si verifica all’anodo? Il catodo?
Soluzione
Per ispezione, Cr viene ossidato quando tre elettroni vengono persi per formare Cr3+ e Cu2+ viene ridotto mentre guadagna due elettroni per formare Cu. Bilanciamento della carica dà
\
Notazione cella utilizza la forma più semplice di ciascuna delle equazioni, e inizia con la reazione all’anodo. Non sono state specificate concentrazioni così:
\
L’ossidazione avviene all’anodo e la riduzione al catodo.
Esempio \(\PageIndex{2}\): Usando la notazione cellulare
Considera una cella galvanica composta da
Scrivi le mezze reazioni di ossidazione e riduzione e scrivi la reazione usando la notazione cellulare. Quale reazione si verifica all’anodo? Il catodo?
Soluzione
Per ispezione, Fe2+ subisce ossidazione quando un elettrone viene perso per formare Fe3+ e MnO4− viene ridotto mentre guadagna cinque elettroni per formare Mn2+. Bilanciamento della carica dà
\
Notazione cella utilizza la forma più semplice di ciascuna delle equazioni, e inizia con la reazione all’anodo. È necessario utilizzare un elettrodo inerte, come il platino, perché non è presente alcun metallo per condurre gli elettroni dall’anodo al catodo. Non sono state specificate concentrazioni così:
\
L’ossidazione avviene all’anodo e la riduzione al catodo.
Esercizio \(\PageIndex{1}\)
Usa la notazione cellulare per descrivere la cella galvanica in cui gli ioni rame(II) sono ridotti a metallo di rame e il metallo di zinco è ossidato a ioni di zinco.
Rispondi
Dalle informazioni fornite nel problema:
\
Usando la notazione delle celle:
\
Sommario
Le celle elettrochimiche consistono tipicamente di due mezze celle. Le mezze celle separano la mezza reazione di ossidazione dalla mezza reazione di riduzione e rendono possibile il flusso di corrente attraverso un filo esterno. Una mezza cella, normalmente raffigurata sul lato sinistro in una figura, contiene l’anodo. L’ossidazione avviene all’anodo. L’anodo è collegato al catodo nell’altra metà cella, spesso mostrato sul lato destro in una figura. La riduzione avviene al catodo. L’aggiunta di un ponte di sale completa il circuito permettendo alla corrente di fluire. Anioni nel flusso ponte sale verso l’anodo e cationi nel flusso ponte sale verso il catodo. Il movimento di questi ioni completa il circuito e mantiene ogni mezza cella elettricamente neutra. Le celle elettrochimiche possono essere descritte usando la notazione cellulare. In questa notazione, le informazioni sulla reazione all’anodo appaiono a sinistra e le informazioni sulla reazione al catodo a destra. Il ponte di sale è rappresentato da una doppia linea,‖. Le fasi solide, liquide o acquose all’interno di una mezza cella sono separate da una singola linea, │. La fase e la concentrazione delle varie specie sono incluse dopo il nome della specie. Gli elettrodi che partecipano alla reazione di riduzione dell’ossidazione sono chiamati elettrodi attivi. Gli elettrodi che non partecipano alla reazione di riduzione dell’ossidazione ma sono lì per consentire alla corrente di fluire sono elettrodi inerti. Gli elettrodi inerti sono spesso realizzati in platino o oro, che sono invariati da molte reazioni chimiche.
Glossario
elettrodo attivo elettrodo che partecipa alla reazione di riduzione dell’ossidazione di una cella elettrochimica; la massa di un elettrodo attivo cambia durante la reazione di riduzione dell’ossidazione elettrodo anodo in una cella elettrochimica in cui si verifica l’ossidazione; informazioni circa l’anodo è registrato sul lato sinistro del ponte salino nella cella notazione catodo elettrodo di una cella elettrochimica in cui avviene la riduzione, le informazioni sul catodo è registrato sul lato destro del ponte salino nella cella notazione cella notazione stenografica per rappresentare le reazioni in una cella elettrochimica cella potenziale differenza di potenziale elettrico che si verifica quando i metalli dissimili sono collegati; la forza trainante per il flusso di carica (corrente) in reazioni di ossido-riduzione cella galvanica cella elettrochimica che coinvolge una spontanea reazione di ossido riduzione; celle elettrochimiche con cellule positive potenzialità; anche chiamato una cella voltaica inerte elettrodo che permette alla corrente di fluire, ma che non partecipano alla reazione di ossido riduzione in una cella elettrochimica; la massa di un elettrodo inerte non cambia durante la reazione di ossido riduzione; gli elettrodi inerti sono spesso fatti di platino o oro perché questi metalli sono chimicamente non reattivi. cella voltaica un altro nome per una cella galvanica
Contributori e attribuzioni
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) e Richard Langley (Stephen F. Austin State University) con autori contributori. I contenuti dei libri di testo prodotti da OpenStax College sono rilasciati sotto licenza Creative Commons Attribution License 4.0. Scarica gratuitamente a http://cnx.org/contents/85abf193-2bd…[email protected]).