Next: 3.4 Frigoriferi e Calore: 3. La prima legge Precedente: 3.2 Rappresentazione generalizzata dei contenuti Indice
Un ciclo di Carnot è mostrato in Figura 3.4. Ha quattro processi. Ci sono due gambe reversibili adiabatiche e duegambe reversibili termiche. Possiamo costruire un ciclo di Carnot con molti sistemi diversi, ma i concetti possono essere mostrati usando un fluido di lavoro familiare, il gas ideale. Il sistema può essere considerato comeuna camera chiusa da un pistone e riempita con questo gas ideale.
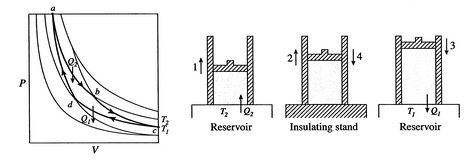
I quattro processi del ciclo di Carnot sono:
- Il sistema è alla temperatura
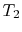 allo stato
allo stato  . È portato a contatto con un serbatoio di calore, che è solo una massa liquida o solida di grande misura tale che la sua temperatura non cambia sensibilmente quando una certa quantità di calore viene trasferita al sistema. In altre parole, il serbatoio di calore è una temperatura costantefonte (o ricevitore) di calore. Il sistema è quindi sottoposto a anisothermal espansione
. È portato a contatto con un serbatoio di calore, che è solo una massa liquida o solida di grande misura tale che la sua temperatura non cambia sensibilmente quando una certa quantità di calore viene trasferita al sistema. In altre parole, il serbatoio di calore è una temperatura costantefonte (o ricevitore) di calore. Il sistema è quindi sottoposto a anisothermal espansione 
 , con il calore assorbito
, con il calore assorbito 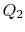 .
. - Atstate
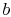 , il sistema è isolato termicamente (rimosso dal contactwith il serbatoio di calore) e quindi lasciare espandere a
, il sistema è isolato termicamente (rimosso dal contactwith il serbatoio di calore) e quindi lasciare espandere a 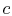 . Durante questa espansione la temperatura diminuisce a
. Durante questa espansione la temperatura diminuisce a 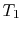 . Il calore scambiatodurante questa parte del ciclo,
. Il calore scambiatodurante questa parte del ciclo, 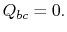 )
) - Allo stato
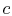 il sistema viene portato a contatto con un serbatoio di calore a temperatura
il sistema viene portato a contatto con un serbatoio di calore a temperatura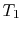 . Viene quindi compresso per indicare
. Viene quindi compresso per indicare 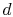 , rifiutando il calore
, rifiutando il calore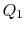 nel processo.
nel processo. - Infine, il sistema viene compresso adiabaticamente allo stato iniziale
 . Lo scambio termico
. Lo scambio termico 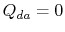 .
.
L’efficienza termica del ciclo è data dalla definizione
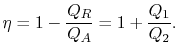 |
(3..4) |
In questa equazione, c’è una convenzione segno implicita. Le quantità![]()
![]() come definite sono le grandezze del calore assorbito e proiettato. Le quantità
come definite sono le grandezze del calore assorbito e proiettato. Le quantità ![]() ,
,![]() invece sono definite con riferimento al calore ricevuto dal sistema. In questo esempio, theformer è negativo e quest’ultimo è positivo. Il calore assorbito e espulso dal sistema avviene durante i processi isotermici e sappiamo già quali sono i loro valori da Eq.(3.1):
invece sono definite con riferimento al calore ricevuto dal sistema. In questo esempio, theformer è negativo e quest’ultimo è positivo. Il calore assorbito e espulso dal sistema avviene durante i processi isotermici e sappiamo già quali sono i loro valori da Eq.(3.1):
L’efficienza può ora essere scritta in termini di volumi negli stati diversi come
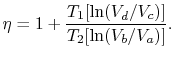 |
(3..5) |
The path from states ![]() to
to ![]() and from
and from ![]() to
to ![]() are bothadiabatic and reversible. For a reversible adiabatic process we knowthat
are bothadiabatic and reversible. For a reversible adiabatic process we knowthat ![]() . Using the ideal gas equation ofstate, we have
. Using the ideal gas equation ofstate, we have ![]() . Along curve
. Along curve![]()
![]() , therefore,
, therefore, ![]() . Alongthe curve
. Alongthe curve ![]()
![]()
![]() . Thus,
. Thus,

Comparing the expression for thermal efficiencyEq. (3.4) with Eq. (3.5) mostradue conseguenze. Innanzitutto, le manche ricevute e rifiutate sono relazionate alle temperature delle parti isotermiche del ciclo da
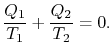 |
(3..6) |
In secondo luogo, l’efficienza di un ciclo di Carnot è data in modo compatto da
 |
(3..7) |
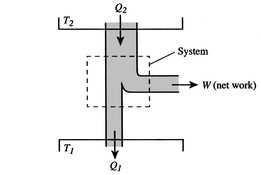
L’efficienza può essere del 100% solo se la temperatura alla quale il calore viene rifiutato è zero. I trasferimenti di calore e di lavoro da e verso il sistema sono mostrati schematicamente inFigure 3.5.
Fangoso Punti
Dal ![]() guardando il
guardando il ![]()
![]() grafico, doesthat significa il più lontano a parte il
grafico, doesthat significa il più lontano a parte il ![]()
![]() isoterme sono, thegreater efficienza? E che se fossero molto vicini, lo sarebbemolto inefficiente? (MP 3.2)
isoterme sono, thegreater efficienza? E che se fossero molto vicini, lo sarebbemolto inefficiente? (MP 3.2)
Nel ciclo di Carnot, perché abbiamo a che fare solo con variazioni di volume e non con variazioni di pressione sugli adiabati e sulle isoterme?(MP 3.3)
Esiste un’applicazione fisica per il ciclo di Carnot? Possiamo progettare un motore Carnot per un dispositivo di propulsione?(MP 3.4)
Come facciamo a sapere quali cicli utilizzare come modelli per processi reali?(MP 3.5)
Next: 3.4 Frigoriferi e Calore: 3. La prima legge precedente: 3.2 Rappresentazione generalizzata dei contenuti Index
UnifiedTP