L’ibridazione teoria è spesso visto come un lungo e confuso concetto e una pratica di abilità per essere in grado di determinare rapidamente se l’atomo è la sp3, sp2 o sp, senza dover passare attraverso tutti i dettagli di come l’ibridazione era accaduto.
Fortunatamente, c’è una scorciatoia nel fare questo e in questo post, cercherò di riassumere questo in alcuni passaggi distinti che devi seguire.
Diciamo che ti viene chiesto di determinare lo stato di ibridazione per gli atomi numerati nella seguente molecola:

La prima cosa che devi fare è determinare il numero dei gruppi che si trovano su ciascun atomo. Per gruppi, intendiamo atomi o coppie solitarie di elettroni. Questo è anche noto come il numero sterico (SN).

Di seguito sono riportati alcuni esempi di numeri sterici 2-4 che è in gran parte ciò che è necessario sapere in chimica organica:

Si noti che i legami multipli non contano, sono atomi + coppie solitarie per qualsiasi tipo di legame.
una Volta che si sa come determinare il numero sterico (è la teoria VSEPR), basta applicare la seguente correlazione:
Se il numero sterico è di 4, è sp3
Se il numero sterico è 3 – sp2
Se il numero sterico è di 2 – sp
ora, torniamo alla nostra molecola e determinare l’ibridazione stati per tutti gli atomi.
C1 – SN = 3 (tre atomi collegati), quindi non è sp2
C2 – SN = 3 (tre atomi collegati), quindi non è sp2
O4 – SN = 3 (1 atomo + 2 lone pairs), quindi non è sp2
O5 – SN = 4 (2 atomi di + 2 lone pairs), quindi è sp3
C6 – SN = 4 (4 atomi), quindi non è la sp3
C7 – SN = 4 (4 atomi), quindi non è la sp3
N8 – SN = 4 (3 atomi di + 1 lone pair), quindi non è la sp3
C9 – SN = 2 (2 atomi), quindi è sp
C10 – SN = 2 (2 atomi), quindi non è sp

In aggiunta a questo metodo, è anche molto utile ricordare alcuni tratti legati alla struttura e ibridazione. In generale, un atomo con tutti i singoli legami è un sp3 ibridato. Il miglior esempio sono gli alcani. Tutti gli atomi di carbonio in un alcano sono ibridati sp3 con geometria tetraedrica.
I carboni in alcheni e altri atomi con un doppio legame sono spesso ibridati sp2 e hanno geometria planare trigonale.
Il triplo legame, d’altra parte, è caratteristico per gli alchini in cui gli atomi di carbonio sono ibridati sp.
Ci sono alcune eccezioni comuni a ciò che abbiamo discusso sulla determinazione dello stato di ibridazione e sono per lo più legate al metodo in cui guardiamo il tipo di legame dell’atomo.
Ad esempio, nell’anidride carbonica (CO2), il carbonio ha due doppi legami, ma è ibridato sp.
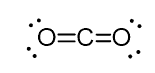
E la ragione di ciò è il fatto che il numero sterico del carbonio è due (ci sono solo due atomi di ossigeno collegati ad esso) e per mantenere due atomi a 180o, che è la geometria ottimale, il carbonio deve usare due orbitali identici. Questo è possibile solo nell’ibridazione sp. Gli altri due orbitali 2p sono utilizzati per realizzare i doppi legami su ciascun lato del carbonio.
Un altro esempio comune e molto importante sono le carbocazioni.

Qui il carbonio ha solo legami singoli e potrebbe sembrare che dovrebbe essere ibridato sp3. Tuttavia, il carbonio in questo tipo di carbocazioni è ibridato sp2. Ancora una volta, per lo stesso motivo, che il suo numero sterico è 3 (sp2 – tre orbitali identici).
Un’eccezione al metodo del numero sterico
Un’eccezione con il numero sterico è, ad esempio, le ammidi. L’atomo di azoto qui ha il numero sterico 4 e dovrebbe essere sp3. Tuttavia, a causa della delocalizzazione di risonanza della coppia solitaria, interconverte da sp3 a sp2 in quanto è l’unico modo di avere gli elettroni in un orbitale p allineato che può sovrapporsi e partecipare alla stabilizzazione di risonanza con gli elettroni del legame pi del doppio legame C=O.

Nella maggior parte dei casi, non dovrai preoccuparti delle eccezioni se vai in base al numero sterico.