Una cella voltaica, spesso conosciuta come cella galvanica, fornisce energia elettrica. La fonte di questa energia è una reazione chimica spontanea, più specificamente una reazione redox spontanea.
Ad esempio, tutte le batterie sono costituite da una o più celle voltaiche;le batterie si scaricano quando la maggior parte o tutti i loro reagenti sono stati convertiti in prodotti, trasformando la loro energia potenziale chimica in energia elettrica.
Celle voltaiche-Il processo di base
Energia potenziale chimica → Energia elettrica
La cella voltaica è uno dei due tipi fondamentali di celle elettrochimiche.L’altro tipo è la cella elettrolitica; in una cella elettrolitica, l’energia elettrica viene utilizzata per guidare una reazione chimica non spontanea.Ad esempio, l’acqua può essere divisa in idrogeno e ossigeno in una cella elettrolitica. Inoltre, quando una batteria ricaricabile viene ricaricata, funziona come una cella elettrolitica.
Schema delle celle voltaiche di base
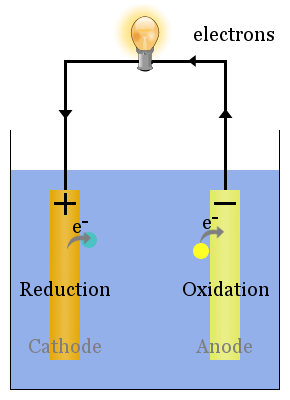
Le reazioni redox spontanee agli elettrodi producono una tensione.Impostata correttamente, questa tensione può guidare elettroni attraverso dispositivi elettrici, come la lampadina mostrata here.In questo diagramma, le specie trasferiscono elettroni all’anodo da dove fluiscono attraverso la lampadina al catodo, dove provocano la riduzione.
Schema elettrolitico di base delle celle
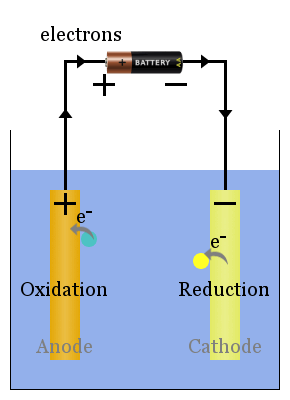
Non spontaneo le reazioni redox sono guidate da una tensione esterna.I processi della cella elettrolitica sono l’opposto di quelli della cella voltaica. La corrente dalla fonte di energia spinge gli elettroni al catodo, dove causano la riduzione delle specie.
Per saperne di più qui su catodi e anodi in voltaico vs celle elettrolitiche.
Esempio di cella voltaica
La batteria Edison
La batteria Edison è una semplice cella ricaricabile inventata da Thomas Edison.It consiste di due elettrodi metallici, uno di ferro, l’altro di nichel.Durante la carica iniziale, un rivestimento di ossido di nichel si forma sull’elettrodo di nichel.
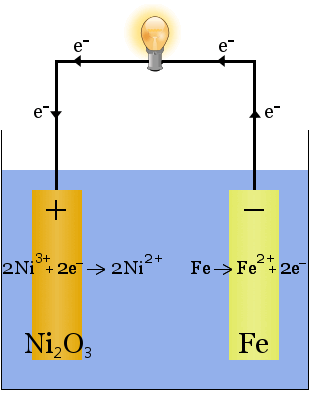
L’elettrolita (il liquido ionico tra gli elettrodi) è del 20-30% in peso di idrossido di potassio in acqua.Il ruolo dell’idrossido di potassio in questo caso è quello di aumentare la conduttività ionica per completare il circuito elettrico – l’idrossido di potassio non viene consumato nella reazione.
Quando si scarica, la cella Edison funziona come una cella voltaica.Quando è in carica, la cella funziona come una cella elettrolitica.
Le equazioni chimiche per le reazioni agli elettrodi sono:
Durante la scarica, quando la cella fornisce energia elettrica, le reazioni sopra riportate procedono verso destra →.
Durante la carica, quando la cella sta convertendo l’energia elettrica in energia potenziale chimica, le reazioni sopra procedono verso sinistra ←.
La cella Edison, con entrambi gli elettrodi che condividono lo stesso elettrolita, è una delle celle voltaiche più semplici nell’uso pratico; la maggior parte delle celle voltaiche sono più complicate.I suoi grandi vantaggi sono la sua notevole robustezza contro errori come il sovraccarico e la sua vita lavorativa molto lunga, con un ciclo di carica-scarica quasi illimitato.
Il suo più grande svantaggio è che, rispetto alla sua produzione di energia, è molto pesante.
Ulteriore esempio
Batterie al litio
I progressi nella tecnologia delle batterie hanno guidato la miniaturizzazione dei dispositivi elettronici.Senza questi progressi, dispositivi moderni come cellulari e tablet sarebbero più grandi e più ingombranti.
Al centro di questi progressi è stata la tecnologia agli ioni di litio.L’elemento litio è un metallo di densità molto bassa: a 0,534 g / cm3 il litio è denso la metà dell’acqua; il litio galleggia sull’acqua.Confrontalo con i metalli nella cella Edison, la densità del nichel è 8,908 g/cm3 e quella del ferro è 7,874 g / cm3: questi sono più di 10 volte superiori alla densità del litio.
L’alto potenziale redox del litio combinato con la sua bassa densità rende i suoi ioni perfetti per l’uso come materiale della batteria.
Una tipica batteria agli ioni di litio si basa su elettrodi porosi che consentono agli ioni di litio di muoversi dentro e fuori dai loro pori.Ad esempio, una batteria ricaricabile agli ioni di litio potrebbe avere un elettrodo di grafite e un elettrodo di ossido di cobalto drogato al litio con un elettrolita di poliossietilene contenente il sale LiPF6.
Quando una tale batteria alimenta un dispositivo, gli atomi di litio tenuti all’interno della struttura dello strato dell’anodo di grafite vengono ossidati per diventare ioni.
Al catodo, gli ioni di litio sono ridotti all’interno della struttura dell’ossido di cobalto.
These reactions are reversed when the cell is being charged.
