Introduzione
Le risorse fossili sono la principale materia prima per l’energia e i composti organici e il loro uso si traduce nell’emissione di gas serra associati ai cambiamenti climatici. Il prossimo incidente climatico richiede una transizione urgente da un’economia basata sui fossili a un’economia basata su bio in cui la biomassa lignocellulosica piuttosto che il petrolio viene utilizzata per la produzione di combustibili, prodotti chimici e materiali. Il legno è un’importante fonte di biomassa lignocellulosica; è composto principalmente da pareti cellulari secondarie ispessite ricche di cellulosa, emicellulosi e lignina. Tutti e tre i polimeri possono essere valorizzati nell’economia bio-based. La cellulosa è una fonte per l’industria della cellulosa e della carta, e sia la cellulosa che le emicellulosi possono essere depolimerizzate nei loro monosaccaridi per la fermentazione in, ad esempio, bioetanolo, acido lattico e detergenti (Vanholme et al., 2013b). Poiché la lignina influisce negativamente sull’efficienza della lavorazione del legno verso queste applicazioni, gli alberi possono essere progettati per accumulare meno lignina, per diventare più suscettibili per la produzione di carta e zuccheri fermentabili. D’altra parte, la lignina viene sempre più considerata una componente preziosa nell’economia basata sulla bio. Infatti, dato che la lignina è la più grande fonte aromatica rinnovabile sulla Terra, la redditività economica di una bio-raffineria può essere significativamente aumentata se la lignina viene anche valorizzata e utilizzata come risorsa per la produzione di prodotti chimici (Holladay et al., 2007; Tuck et al., 2012; Davis et al., 2013; Ragauskas et al., 2014; Li C. et al., 2015; Van den Bosch et al., 2015; Rinaldi et al. Nel 2016, Upton e Kasko, 2016; Schutyser et al., 2018).
Il polimero di lignina è composto da monolignoli che sono prodotti dalle vie biosintetiche del fenilpropanoide e del monolignolo, da una serie di reazioni enzimatiche che iniziano con la deaminazione della fenilalanina (Figura 1). I monolignoli sono sintetizzati nel citoplasma e traslocati nell’apoplasto, dove sono deidrogenati a radicali monolignoli dall’azione di laccasi e perossidasi (Berthet et al., 2011; Zhao et al., 2013). Questi radicali monolignolo poi coppia con l’altro in modo combinatorio, generando una gamma di legami chimici come il legame aril-etere (β-O-4), legame resinolo (β-β), e legame fenilcoumarano (β-5) (Boerjan et al., 2003; Ralph et al., 2004; Vanholme et al., 2010). I monolignoli più comuni sono gli alcoli idrossicinnamilici p-cumarile, coniferile e sinapile, che generano le unità H, G e S dopo la loro incorporazione nel polimero di lignina, rispettivamente (Bonawitz e Chapple, 2010; Ralph et al., 2019; Vanholme et al., 2019). Il contributo relativo dei blocchi di lignina varia tra taxa, stadio di sviluppo, tipo di tessuto e cellula e persino strato di parete cellulare; la lignina da legni dolci (gimnosperme) è composta quasi interamente da unità G con una frazione minore di unità H, mentre la lignina da legni duri (angiosperme) ha unità S oltre a unità G e tracce di unità H (Boerjan et al., 2003; Vanholme et al., 2010, 2019). Oltre a questi monolignoli tradizionali, una varietà di altre molecole aromatiche p-idrossilate possono essere incorporate nel polimero di lignina a vari livelli (Vanholme et al., 2019).
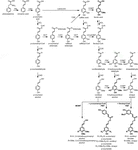
Figure 1. Lignin biosynthetic pathway. Alternative monomers and heterologously expressed enzymes are shown in bold. PAL, phenylalanine ammonia-lyase; C4H, cinnamate 4-hydroxylase; 4CL, 4-coumarate:CoA ligase; HCT, p-Hydroxycinnamoyl-CoA:quinate/shikimate-p-hydroxycinnamoyltransferase; C3’H, p-coumaroyl quinate/shikimate 3’-hydroxylase; CSE, caffeoyl shikimate esterase; CCoAOMT, caffeoyl-CoA O-methyltransferase; CCR, cinnamoyl-CoA reductase; F5H, ferulate 5-hydroxylase/CAld5H, coniferaldehyde 5-hydroxylase; COMT, acido caffeico O-metiltransferasi; CAD, alcol cinnamilico deidrogenasi; FMT, feruloil-CoA monolignolo transferasi; PMT, p-cumaroil-CoA monolignolo transferasi.
Dato che la lignina è un importante fattore di recalcitranza nei processi di delignificazione del legno, grandi sforzi di ricerca sono stati dedicati a svelare il percorso biosintetico della lignina, e per studiare gli effetti delle perturbazioni dei geni di biosintesi della lignina sulla quantità e la composizione della lignina e sull’efficienza della lavorazione del legno. Mentre le modifiche nei geni che vanno da quelli che codificano i fattori di trascrizione fino a quelli che codificano gli enzimi ossidativi hanno portato a un contenuto, una composizione o una deposizione di lignina alterati (Eriksson et al., 2000; Li YH et al., 2003; Liang et al., 2008; Lu et al., 2013; Lin et al., 2016; Xu et al., 2017; Yang et al., 2017; Obudulu et al., 2018), questa recensione si concentrerà sui risultati ottenuti ingegnerizzando i geni biosintetici della lignina.
Engineering the Lignin Pathway
La tabella 1 fornisce una panoramica dei diversi studi sui geni biosintetici della lignina downregolata o mutata in pioppo, pino, eucalipto e betulla, con i conseguenti effetti sulle efficienze di lavorazione del legno, quando determinati. La riduzione dell’attività di qualsiasi fase della via biosintetica della lignina, a partire dal PAL fino al CAD, può comportare una riduzione del contenuto di lignina (Tabella 1). Diversi parametri influenzano il grado di riduzione della lignina, come il gene bersaglio e il grado di downregulation dell’attività enzimatica, che a sua volta dipende dall’efficienza del costrutto di silenziamento utilizzato, dalla dimensione della famiglia genica e dalla ridondanza all’interno della famiglia genica. In generale, la downregulation dei passaggi da C4H fino a CCR si traduce in una riduzione più drammatica della quantità di lignina (Hu et al., 1999; Meyermans et al., 2000; Zhong et al., 2000; Li L. et al., 2003; Jia et al., 2004; Lu et al., 2004; Leplé et al., 2007; Coleman et al., 2008a, b; Bjurhager et al., 2010; Mansfield et al., 2012; Ralph et al., 2012; Min et al., 2014; Van Acker et al., 2014; Zhou et al., 2015, 2018; Saleme et al., 2017; Xiang et al., 2017) rispetto alla downregulation di F5H, COMT e CAD (Van Doorsselaere et al., 1995; Baucher et al., 1996; Lapierre et al., 1999; Jouanin et al., 2000; Van Acker et al., 2014; Wang et al., 2018). La riduzione della lignina può essere associata ad un aumento di S/G, come in C3’H- (Coleman et al., 2008a; Ralph et al., 2012) e alberi CCoAOMT-downregulated (Meyermans et al., 2000), o una diminuzione del rapporto S / G come in CSE – (Saleme et al., 2017), e alberi COMT-downregulated (Van Doorsselaere et al., 1995; Lapierre et al., 1999; Jouanin et al., 2000). È interessante notare che i pioppi a bassa lignina 4CL-downregulated hanno riscontrato un aumento di S / G (Min et al., 2014; Xiang et al., 2017), una diminuzione di S/G (Voelker et al., 2010; Zhou et al., 2015), o rapporti paragonabili a wild type (Hu et al., 1999; Li L. et al., 2003). Questa varianza non può essere associata al promotore o al metodo utilizzato per la downregulation, suggerendo che le differenze nel grado di silenziamento, nelle condizioni di crescita o nello stato di sviluppo influenzano questo tratto. D’altra parte, gli effetti più forti sulla composizione della lignina H/G/S sono stati osservati per gli alberi downregolati in C3’H e HCT, che depositano la lignina con grandi aumenti nel contenuto di unità H (Coleman et al., 2008a; Ralph et al., 2012; Vanholme et al., 2013a), mentre gli alberi che sovraesprimono F5H producono lignina fortemente arricchita in unità S (Franke et al., 2000; Li L. et al., 2003; Stewart et al., 2009), e gli alberi che sono downregulated in COMT hanno drasticamente ridotto la biosintesi dell’unità S (Van Doorsselaere et al., 1995; Lapierre et al., 1999).

Tabella 1. Panoramica degli alberi forestali con espressione modificata dei geni della biosintesi della lignina.
L’efficienza di lavorazione della biomassa può anche essere modificata dalla maggiore incorporazione di molecole che generalmente rappresentano componenti minori nella lignina delle piante wild-type. L’incorporazione di acido ferulico in alberi carenti di CCR provoca la formazione di legami acetali nel polimero della lignina, che sono facilmente scissi nei pretrattamenti acidi della biomassa (Leplé et al., 2007; Ralph et al., 2008; Van Acker et al., 2014). In effetti, i livelli di acido ferulico nella lignina si correlavano positivamente con una maggiore efficienza di saccarificazione (Van Acker et al., 2014). L’incorporazione di alcool 5-idrossiconiferilico e 5-idrossiconiferaldeide nella lignina di pioppi carenti di COMT (Van Doorsselaere et al., 1995; Lapierre et al., 1999; Jouanin et al., 2000; Morreel et al., 2004; Lu et al., 2010) dà origine a legami benzodiossani, potenzialmente prevenendo legami covalenti tra lignina e gruppi ossidrilici polisaccaridici (Weng et al., 2010; Vanholme et al., 2012; Nishimura et al., 2018). D’altra parte, la carenza di COMT si traduce anche in una lignina più condensata a causa dei livelli relativamente più elevati dei legami β-β e β-5 condensati e dei livelli più bassi dei legami β-O-4, quando la frequenza dell’unità S diminuisce. La pulitura chimica del legno derivato dai pioppi fortemente regolamentata per COMT ha prodotto una maggiore resa di polpa, controbilanciata dal contenuto residuo di lignina nella polpa. Questi alberi avevano una lignina inferiore e un contenuto di cellulosa più elevato (Jouanin et al., 2000). D’altra parte, i pioppi che erano modestamente downregulated per COMT avevano una grande diminuzione della resa della polpa, presumibilmente perché il contenuto di lignina era rimasto normale mentre la lignina aveva una maggiore frequenza di legami condensati che influenzavano negativamente l’estrazione della lignina (Lapierre et al., 1999; Pilato et al., 2002). L’incorporazione di cinnamaldeidi nel polimero della lignina negli alberi CAD-carenti provoca le più brevi catene del polimero della lignina, quindi una più alta proporzione dei gruppi fenolici liberi dell’estremità che aumentano la solubilità del polimero in alcali. L’incorporazione di cinnamaldeidi nel polimero della lignina presumibilmente riduce anche l’interazione covalente della catena alifatica con l’emicellulosa, rendendo nuovamente la lignina più solubile. Inoltre, a causa del sistema coniugato esteso che viene generato quando una cinnamaldeide β-O-4 si accoppia con un altro monomero, il legame eterico aromatico della cinnamaldeide incorporata diventa più suscettibile alla scissione alcalina (Lapierre et al., 1989; Van Acker et al., 2017).
La polimerizzazione della lignina è un processo di accoppiamento radicale combinatorio, che consente di incorporare naturalmente una vasta gamma di composti fenolici nel polimero della lignina (Boerjan et al., 2003; Vanholme et al., 2019). I ricercatori hanno tentato di adattare la quantità e la composizione della lignina per migliorare l’elaborazione della biomassa mediante l’espressione di geni eterologi, mirando alla biosintesi e all’incorporazione di vari composti fenolici compatibili come monolignoli alternativi nel polimero di lignina (Ralph, 2006; Vanholme et al., 2012; Mottiar et al., 2016; Mahon e Mansfield, 2018). Un esempio è l’introduzione di geni che codificano gli enzimi necessari per la biosintesi dell’unità S nel pino; l’espressione simultanea di F5H, COMT e CAD ha introdotto con successo le unità S nel Pinus radiata (Wagner et al., 2015; Edmunds et al., 2017). L’introduzione del gene che codifica un monolignolo 4-O-metiltransferasi (MOMT4) nel pioppo porta alla formazione di alcoli 4-O-metilati di conifere e sinapile, che non possono essere incorporati nel polimero di lignina in crescita perché mancano del gruppo idrossilico aromatico. Ciò porta ad una battuta d’arresto nella polimerizzazione della lignina e si traduce in alberi con contenuto di lignina inferiore e maggiore efficienza di saccarificazione (Bhuiya e Liu, 2010; Cai et al., 2016). I pioppi inoltre sono stati costruiti per contenere i collegamenti dell’estere nella spina dorsale del polimero della lignina. Gli esteri ferulati di coniferile sono stati introdotti nel polimero tramite l’espressione di un gene FERULOIL-CoA: MONOLIGNOLO TRANSFERASI (FMT) derivato da Angelica sinensis (Wilkerson et al., 2014), portando a una migliore efficienza di saccarificazione in varie condizioni di pretrattamento (Wilkerson et al., 2014; Kim et al., 2017; Bhalla et al., 2018) e un’efficienza di spappolamento kraft migliorata rispetto al tipo selvaggio (Zhou et al., 2017). Gli esteri di monolignolo p-cumarati sono stati anche ingegnerizzati nel pioppo, tramite l’espressione di un gene p-CUMAROIL-CoA di riso: MONOLIGNOLO TRANSFERASI (PMT), con conseguente maggiore frequenza di legami interunitari resistenti e una maggiore frequenza di unità terminali G e S con gruppi fenolici liberi (Smith et al., 2015; Sibout et al., 2016). Mentre in Arabidopsis l’espressione eterologa di PMT ha provocato una quantità ridotta di lignina accompagnata da una maggiore efficienza di saccarificazione (Sibout et al., 2016), non vi è stata alcuna diminuzione della quantità di lignina nel pioppo e l’efficienza di saccarificazione non è stata determinata (Smith et al., 2015).
Mentre diverse modifiche della quantità e della composizione della lignina hanno dimostrato di fornire miglioramenti nel trattamento della biomassa, queste modifiche sono state spesso accompagnate da una riduzione della resa della biomassa (Leplé et al., 2007; Wadenbäck et al., 2008; Wagner et al., 2009; Voelker et al., 2010; Stout et al., 2014; Van Acker et al., 2014; Sykes et al., 2015; Zhou et al., 2018). Una recente metastudy perturbato 21 lignina biosintesi geni in P. trichocarpa e ha integrato in modo completo i risultati dei dati trascrittomici, proteomici, fluxomici e fenomici di 221 linee. Gli autori hanno concluso che la crescita degli alberi non è associata alla quantità di lignina, alla composizione di subunità o a legami specifici (Wang et al., 2018), ma piuttosto correlato alla presenza di vasi xilemici collassati (Coleman et al., 2008a, b; Wagner et al., 2009; Voelker et al., 2010; Vargas et al., 2016; De Meester et al., 2018), l’attivazione di un percorso di integrità della parete cellulare (Bonawitz et al., 2014) e/o l’accumulo di inibitori chimici (Gallego-Giraldo et al., 2011; Muro-Villanueva et al., 2019).
Mentre sono stati fatti notevoli sforzi per ridurre il contenuto di lignina mediante la downregolazione dei geni biosintetici della lignina, gli studi sulla sovraregolazione della via della lignina e la sovrapproduzione di lignina sono stati scarsi. In effetti, i rapporti sulla sovraespressione di F5H mostrano un invariato o addirittura una diminuzione del contenuto di lignina (Huntley et al., 2003; Li L. et al., 2003; Stewart et al., 2009; Mansfield et al., 2012; Edmunds et al., 2017). La sovraespressione di CAD e COMT ha portato al silenziamento genico piuttosto che alla sovraregolazione, o non è stato rilevato alcun effetto sui livelli di espressione (Baucher et al., 1996; Lapierre et al., 1999; Jouanin et al., 2000; Leplé et al., 2007; Van Acker et al., 2014). La sovraespressione dei fattori di trascrizione R2R3-MYB PtoMYB92, PtoMYB216 e PtoMYB74 ha portato a strati di xilema aggiuntivi, pareti cellulari dello xilema più spesse e deposizione di lignina ectopica e le piante hanno accumulato il 13-50% in più di lignina (Tian Q. et al., 2013; Li C. F. et al., 2015; Li et al., 2018). Le linee di sovraespressione di MYB hanno costitutivamente sovraregolato i geni della via di biosintesi della lignina, e mentre le piante che sovraesprimevano MYB92 e MYB74 avevano una penalità di biomassa, la sovraespressione di MYB216 ha portato a piante con fino al 50% in più di lignina e nessun fenotipo di sviluppo. Poiché la lignina è sempre più considerata una risorsa importante per la produzione sostenibile di sostanze chimiche (Cao et al., 2018) l’ingegneria delle piante che producono lignina in eccesso dovrebbe essere ulteriormente esplorata.
Prove sul campo
Gli esempi discussi sopra mostrano chiaramente che l’ingegneria della lignina attraverso la down – o upregulation dei geni pathway fenilpropanoidi – o l’espressione di geni eterologhi – ha il potenziale per aumentare l’efficienza di elaborazione della biomassa lignocellulosica. Per motivi pratici e normativi, la maggior parte degli studi riporta i dati ottenuti dall’analisi degli alberi coltivati in serra. Tuttavia, gli esperimenti con alberi coltivati in una serra in genere non tengono conto dei processi di sviluppo come la cessazione della crescita e la dormienza. Inoltre, gli esperimenti in serra non forniscono informazioni sufficienti sull’interazione dell’impianto ingegnerizzato con fattori ambientali come il tipo di suolo, il vento e gli agenti patogeni. Comprendere queste interazioni è un passo importante nella traduzione dei risultati della ricerca verso applicazioni commerciali. Infatti, il corpo di lavoro prodotto da studi per i quali è stato concesso il permesso di stabilire prove sul campo, mette in evidenza importanti differenze di fenotipo tra serra – e campo alberi coltivati. La tabella 1 riassume i rapporti sulle prove sul campo eseguite con alberi downregolati 4CL, CCoAOMT, CCR, COMT e CAD.
Confermando il potenziale della biomassa lignocellulosica modificata come substrato per le applicazioni, diversi alberi coltivati a lignina hanno mostrato miglioramenti nella lavorazione del legno. Pioppi downregulated per CCoAOMT coltivato per 5 anni in una prova sul campo a Pechino (Cina), ha mostrato un aumento del glucosio e rilascio di xilosio su saccarificazione (Wang et al., 2012). I pioppi downregulated per CCR e coltivati in una prova sul campo in Francia, si sono rivelati più suscettibili allo spappolamento chimico di kraft (Leplé et al., 2007). Due ulteriori prove sul campo condotte in Francia e Belgio con pioppi CCR-downregulated hanno portato a un miglioramento fino al 160% della produzione di etanolo nei test simultanei di saccarificazione e fermentazione (SSF); tuttavia gli impianti hanno avuto una riduzione della biomassa fino al 50% (Van Acker et al., 2014). Anche le prove sul campo con pioppo CAD-downregolato hanno mostrato risultati promettenti. Questi alberi hanno mostrato leggermente meno lignina rispetto al tipo selvaggio e si sono dimostrati più suscettibili alla delignificazione kraft (Lapierre et al., 1999). Coerentemente, le stesse linee coltivate in prove sul campo su larga scala in Francia e nel Regno Unito hanno mostrato una lieve diminuzione della quantità di lignina e un miglioramento della pasta kraft ritenuta commercialmente rilevante, poiché le piante avevano bisogno del 6% in meno di alcali per ottenere una delignificazione simile a quella degli alberi wild-type (Pilate et al., 2002).
Tuttavia, rapporti contrastanti sulla resa della biomassa e sull’efficienza del trattamento a valle suggeriscono che questi parametri sono fortemente influenzati da fattori ambientali. Mentre uno studio sul campo condotto in Cina utilizzando pioppi downregolati 4CL ha rilevato che, anche con una diminuzione del 28% del contenuto di lignina rispetto al tipo selvaggio, gli alberi avevano circa l ‘ 8% di altezza aumentata (Tian XM et al., 2013), coerente con gli studi sulla serra (Hu et al., 1999), altri studi sul campo hanno rilevato che i pioppi 4CL-downregulated avevano diminuito la biomassa e talvolta erano persino sminuiti (Voelker et al., 2010; Stout et al., 2014; Marchin et al., 2017). Le relazioni divergono anche per quanto riguarda l’efficienza di lavorazione a valle del legno derivato da questi pioppi coltivati in campo 4CL-downregulated. Mentre è stato riscontrato un aumento fino al 100% del recupero dello zucchero per gli alberi 4CL1-downregulated (costrutto antisenso 4CL guidato da 35S) coltivato in un sito di montagna negli Stati Uniti (Xiang et al., 2017), i dati ottenuti da studi sul campo condotti in Oregon (Stati Uniti) hanno rilevato che i pioppi 4CL1 antisenso silenziati da promotori Pt4CL1 non avevano alcun miglioramento nell’efficienza di saccarificazione rispetto al tipo selvaggio (Voelker et al., 2010). Allo stesso modo, uno studio a lungo termine a Wenling (Cina), ha rilevato che i pioppi 4CL-downregulated non hanno mostrato un miglioramento significativo della resa zuccherina rispetto al tipo selvaggio (Wang et al., 2012). In entrambi gli ultimi casi, gli alberi hanno mostrato lievi diminuzioni della quantità di lignina che non si sono tradotte in una maggiore efficienza di lavorazione, potenzialmente a causa della maggiore concentrazione di estrattivi che potrebbero interferire con l’attività enzimatica (Voelker et al., 2010).
Studi sul campo hanno dimostrato che i fattori ambientali possono influenzare la lignificazione e ripristinare i tratti a livelli di tipo selvaggio rispetto ai livelli raggiunti quando le stesse piante sono state coltivate in serra. Mentre gli alberi 4CL-downregulated avevano diminuito il contenuto di lignina quando coltivati in condizioni di serra, l’analisi degli stessi pioppi antisenso 4CL, ma coltivati sul campo, ha spesso dimostrato che il contenuto di lignina era aumentato rispetto agli alberi coltivati in serra e talvolta persino ripristinato a livelli di tipo selvaggio (Stout et al., 2014; Xiang et al., 2017). Allo stesso modo, i livelli di lignina erano molto meno ridotti nei pioppi carenti di CCR quando venivano coltivati sul campo rispetto a quando venivano coltivati in serra (Van Acker et al., 2014). Almeno per i pioppi CCR-carenti, è possibile che il più alto livello di lignificazione degli alberi coltivati in campo sia dovuto al fatto che i campioni di legno sono stati prelevati durante l’inverno. Quando la crescita degli alberi cessa in autunno, gli alberi hanno ancora il tempo di lignificare completamente le loro pareti cellulari nel momento in cui l’albero entra in dormienza, rispetto agli alberi coltivati in serra che sviluppano continuamente nuovo xilema. È stato anche dimostrato che la composizione della lignina differisce tra alberi a bassa lignina coltivati in serra e in campo. 4CL-i pioppi downregulated coltivati in un campo nella Carolina del Nord avevano lignina con un S/G inferiore rispetto a quando le stesse linee venivano coltivate nella serra (Stout et al., 2014).
Nel loro insieme, questi risultati mostrano che i dati ottenuti dagli alberi coltivati in serra non possono essere facilmente estrapolati agli alberi coltivati in campo, il che sostiene la necessità di esperimenti sul campo in luoghi diversi. Alcune linee hanno presentato una penalità di rendimento rendendole meno interessanti per le applicazioni, evidenziando la necessità di una migliore comprensione delle basi molecolari della penalità di rendimento e lo sviluppo di strategie per superare questo problema.
La lignina ha dimostrato di svolgere un ruolo importante nella resistenza agli agenti patogeni (Miedes et al., 2014; Zhao e Dixon, 2014), e svolge un ruolo fondamentale nel consentire all’impianto di trasportare acqua. Ciò suggerisce che le modifiche della lignina potrebbero avere un impatto sulla tolleranza allo stress delle piante. Mentre sono necessarie ulteriori indagini per affrontare pienamente questa possibilità, la downregulation di 4CL, COMT e CAD nel pioppo non ha alterato drasticamente le prestazioni di alimentazione degli erbivori che alimentano le foglie (Tiimonen et al., 2005; Brodeur-Campbell et al., 2006; Hjalten et al., 2013). L’effetto della downregulation di COMT e CAD nel pioppo sulle interazioni pianta-insetto è stato valutato anche sugli alberi coltivati in campo, ed è stato dimostrato che gli alberi modificati dalla lignina avevano un’incidenza normale di visitare e nutrire gli insetti, nonché risposte normali ai patogeni microbici (Pilato et al., 2002; Halpin et al., 2007). Questi risultati indicano che gli alberi con lignina modificata non soffrono necessariamente più delle piante selvatiche da parassiti e malattie. Tuttavia, la profilatura del microbioma batterico dell’endosfera del legno raccolto da pioppi coltivati in campo, CCR-downregulated ha dimostrato cambiamenti nella comunità batterica, presumibilmente a causa dell’alterata abbondanza di particolari metaboliti fenolici nello xilema (Beckers et al., 2017).
Considerando il ruolo della lignina nella funzione e nella struttura dello xilema, sono state valutate le relazioni idriche di alcuni pioppi a bassa lignina modificati. 4CL-downregulated pioppi sono stati trovati per avere una ridotta conduttività idraulica, potenzialmente interferire con la crescita delle piante (Marchin et al., 2017). Esperimenti di stress idraulico con pioppi downregulated per CCR, COMT o CAD hanno mostrato che queste piante avevano una minore resistenza alla cavitazione, pur mantenendo la normale conduttività idraulica dello xilema e il trasporto dell’acqua (Awad et al., 2012). Questi risultati suggeriscono che la crescita dei mutanti a bassa lignina potrebbe essere influenzata dalla disponibilità di acqua. Come per qualsiasi nuovo ibrido ottenuto dall’allevamento classico, sono necessari test sul campo per valutare le prestazioni sul campo e la tolleranza allo stress degli alberi ingegnerizzati con lignina.
Prospettive per l’ingegneria della lignina negli alberi forestali
Le prestazioni degli impianti progettati per la lignina sembrano essere fortemente influenzate dalle condizioni ambientali. Non è chiaro, tuttavia, se le differenze osservate tra alberi coltivati in serra e coltivati in campo, o tra alberi coltivati in diverse posizioni di campo, derivino da diversi livelli di soppressione genica o dall’interazione del tratto ingegnerizzato con l’ambiente (GxE). Infatti, downregulation instabile è una mancanza di tecniche di silenziamento genico che si basano su RNAi. Ciò è testimoniato osservando la variazione nel fenotipo rosso dello xilema che si osserva quando particolari geni di biosintesi della lignina, come CAD, COMT o CCR, sono downregolati. La colorazione dello xilema rosso spesso non è uniforme in tutto lo xilema, ma appare piuttosto in patch che riflettono livelli variabili di silenziamento genico (Leplé et al., 2007; Voelker et al., 2010; Van Acker et al., 2014; Figura 2). Inoltre, l’uso di metodi di silenziamento genico può potenzialmente causare il silenziamento concomitante di membri della famiglia genica strettamente correlati-forse in vari gradi-offuscando le interpretazioni e camuffando gli effetti della downregulation dei singoli geni.

Figura 2. Downregulation gene patchy da RNAi. Fenotipo di xilema rosso a chiazze osservato su tronchi di pioppi carenti di CCR (a destra) cresciuti in una prova sul campo in Belgio. Lo xilema rosso indica aree di downregulation CCR. Il legno degli alberi selvatici è biancastro (a sinistra).
Questi problemi possono ora essere facilmente superati dall’uso di tecnologie di editing genico basate su CRISPR che consentono mutazioni stabili di perdita di funzione (knock-out) in specifici geni bersaglio, consentendo la dissezione della funzione dei singoli geni all’interno delle famiglie. Ad esempio, il targeting di singoli membri della famiglia di geni 4CL nel pioppo ha mostrato che 4CL1 è correlato alla lignificazione, mentre 4CL2 è coinvolto nella produzione di proantocianidina (Zhou et al., 2015). Oltre agli alleli knock-out, l’editing genetico basato su CRISPR consente anche di creare nuovi alleli che conferiscono una parziale riduzione dell’attività enzimatica. Questo apre la possibilità di mettere a punto il livello di attività enzimatica residua e di bypassare la penalità di resa che si osserva spesso quando la quantità di lignina scende al di sotto di un livello di soglia. Un altro promettente per la lignina ingegneria alberi del bosco, reso possibile attraverso CRISPR base di ingegneria del genoma è la modifica simultanea di più geni (allele stacking) per ottimizzare il trattamento della biomassa efficienza, come esemplificato in Arabidopsis dove impilare i transaldolase (tra) e comt mutazioni, il c4h e comt mutazioni, o il 4cl e comt mutazioni portato additivi e sinergici miglioramenti in saccarificazione efficienza (de Vries et al., 2018). In effetti, un approccio sistemico in P. trichocarpa prevede che la concomitante downregulation di PAL e CCoAOMT, o PAL, C3’H e CCOAOMT migliorerà sostanzialmente le proprietà del legno e il rilascio di zucchero (Wang et al., 2018).
L’uso dell’editing genomico basato su CRISPR nel miglioramento degli alberi per le industrie della cellulosa e della carta e della bio-raffineria, nonché per la produzione di aromatici di piattaforma dalla degradazione idrogenolitica della lignina, sarà più prezioso quando questa tecnologia è combinata strategicamente con altre tecniche di allevamento (Figura 3). In effetti, grandi variazioni nella quantità di lignina e nella composizione S/G esistono già nelle popolazioni naturali di alberi forestali (Studer et al., 2011). Dato che entrambi i tratti influenzano il rilascio di glucosio al momento della saccarificazione (Yoo et al., 2018), sfruttando questa diversità genetica mediante l’allevamento convenzionale, aiutato da studi di associazione Genome Wide (GWAS) (Porth et al., 2013; Fahrenkrog et al., 2017; Liu et al., 2018), Allevamento con rari alleli difettosi (BRDA) (Vanholme et al., 2013a) o selezione genomica (Yin et al., 2010; Muchero et al., 2015; Pawar et al., 2018; Xie et al., 2018), è una strategia preziosa per ottenere linee che hanno migliorato l’efficienza della lavorazione del legno. Una volta ottenuti gli alberi d’élite con questi metodi di allevamento, l’ingegneria genetica e l’editing genetico basato su CRISPR di geni specifici sono una strada molto promettente per migliorare ulteriormente questi genotipi d’élite senza rompere la loro costituzione genetica e senza passare attraverso lunghi cicli di riproduzione. Dato l’imminente crollo climatico, non abbiamo più tempo da perdere nell’adozione di queste nuove tecniche di allevamento nella nostra corsa all’economia biobased.
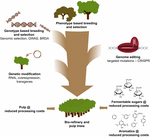
Figura 3. Miglioramento genetico degli alberi forestali attraverso una combinazione di strumenti di allevamento. Per accelerare il miglioramento genetico degli alberi forestali per applicazioni di polpa e bioraffineria, è necessario combinare in modo intelligente strumenti di allevamento classici e nuovi. L’allevamento classico prevede la selezione fenotipica degli alberi per croci controllate, seguita dalla selezione fenotipica. Con l’avvento delle informazioni sulla sequenza del genoma di molti alberi forestali, sono state sviluppate nuove strategie come la selezione genomica, gli studi di associazione Genome Wide (GWAS) e l’allevamento con rari alleli difettosi (BRDA) per accelerare la cattura e l’arricchimento dei polimorfismi del DNA associati a tratti benefici. CRISPR-based genome editing permette di modificare il genoma in un modo che imita polimorfismi naturali. La modificazione genetica comporta l’integrazione stabile di DNA estraneo nell’albero per sovrapprodurre (an) enzimi(s) o downregulate (a) gene(s). La combinazione delle tecniche di allevamento classiche e nuove è necessaria per fornire sufficiente legno di alta qualità per la società.
Contributi degli autori
Tutti gli autori elencati hanno dato un contributo sostanziale, diretto e intellettuale al lavoro, e lo hanno approvato per la pubblicazione.
Finanziamento
Riconosciamo il finanziamento parziale del progetto IWT-SBO BIOLEUM (Grant No. 130039) e di SBO-FISH attraverso il progetto ARBOREF. AC ha ricevuto finanziamenti dal FWO e dal programma di ricerca e innovazione Horizon 2020 dell’Unione Europea nell’ambito della convenzione di sovvenzione Marie Skłodowska-Curie n. 665501. LdV è stato finanziato dall’Istituto per la promozione dell’innovazione attraverso la scienza e la tecnologia nelle Fiandre (IWT-Vlaanderen) per una borsa di studio predottorale.
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Ringraziamenti
Ringraziamo Annick Bleys per aver preparato questo manoscritto per la presentazione.
Boerjan, W., Ralph, J. e Baucher, M. (2003). Biosintesi della lignina. Annu. Rev. Pianta Biol. 54, 519–546.
PubMed Abstract/Google Scholar
Lapierre, C., Pollet, B., Petit-Conil, M., Toval, G., Romero, J., Pilato, G., et al. (1999). Le alterazioni strutturali delle lignine nei pioppi transgenici con attività depressa dell’alcool cinnamilico deidrogenasi o dell’acido caffeico O-metiltransferasi hanno un impatto opposto sull’efficienza della spappolamento industriale di kraft. Impianto Physiol. 119, 153–163.
PubMed Abstract/Google Scholar
Ralph, J. (2006). “Cosa rende un buon sostituto monolignol?, “in The Science and Lore of the Plant Cell Wall-Biosintesi, Struttura e funzione, ed. T. Hayashi (Boca Raton, FL: BrownWalker Press).
Google Scholar