U. S. Pharm. 2008;33 (4) (Oncology suppl): 20-30.
ABSTRACT: Circa il 75% delle donne in postmenopausa con cancro al seno hanno ormone recettore-positivo (HR+) malattia.1 Tamoxifene era lo standard di terapia per il cancro al seno HR + nelle donne in postmenopausa fino all’avvento degli inibitori selettivi dell’aromatasi di terza generazione, che sono anastrozolo, letrozolo ed exemestane.3,4 Questi agenti hanno dimostrato una sopravvivenza libera da malattia superiore negli studi clinici rispetto al tamoxifene, ma il loro beneficio se usato per più di cinque anni nelle donne in postmenopausa con carcinoma mammario HR+ non è stato stabilito.3,4
È stato stimato che tre quarti delle donne in postmenopausa con cancro al seno hanno una malattia positiva al recettore ormonale (HR+).1 Tamoxifen–un modulatore selettivo del estrogeno-ricevitore con gli effetti estrogeni sull’osso, sul tessuto dell’endometrio e sui lipidi ed anti!= effetti estrogenici sul tessuto mammario–era la terapia standard per il cancro al seno HR + nelle donne in postmenopausa fino all’introduzione degli inibitori selettivi dell’aromatasi di terza generazione (AIs).2-4 Questi agenti-anastrozolo, letrozolo ed exemestane – hanno dimostrato una sopravvivenza libera da malattia superiore (DFS) rispetto al tamoxifene negli studi clinici.3,4 Effetti avversi associati all’uso di tamoxifene-cancro endometriale, complicanze tromboemboliche e resistenza al tamoxifene-hanno incoraggiato lo sviluppo di terapie con un diverso meccanismo d’azione, come l’AIs.2
Vedere la TABELLA 1 per un riepilogo delle informazioni importanti sulle IA di terza generazione.
Sfondo
Il chirurgo Scozzese George Beatson descritto ormonale contributo di estrogeni per la carcinogenesi in relazione al cancro al seno in 1896.5 Beatson riconosciuto che la rimozione delle ovaie (ovariectomia) è stata di beneficio nelle donne con inutilizzabile il cancro al seno.5 Questo stato indotto chirurgicamente della privazione dell’estrogeno ha contribuito all’inibizione di crescita del tumore in cellule di cancro al seno in donne con la malattia di HR+.5
Aminoglutethimide, originariamente formulato come agente anticonvulsivante, è stato il primo non specifico AI inizialmente promosso alla fine del 1970 come agente di seconda linea dopo tamoxifene per le donne in postmenopausa con carcinoma mammario HR+ avanzato.6 Effetti collaterali tossici come la soppressione surrenale e la necessità di terapia steroidea ha portato al ritiro di aminoglutetimide dal mercato.6 Nelle donne in postmenopausa con carcinoma mammario HR + in stadio precoce e tardivo, gli AIS di terza generazione dimostrano un migliore profilo di tossicità, una maggiore selettività, una maggiore potenza e una migliore efficacia clinica rispetto agli agenti più anziani. 6
Classificazione4,7
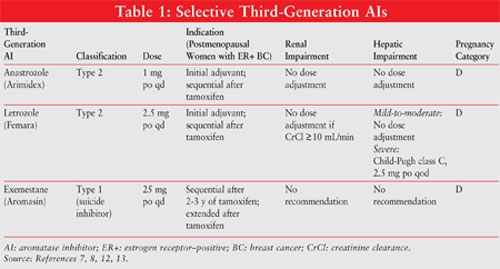
Gli AIS sono classificati come inibitori steroidei di tipo 1 (non competitivi, irreversibili) o non steroidei di tipo 2 (competitivi, reversibili). Exemestane, un tipo 1 inibitore, lega irreversibilmente al sito sulla molecola di aromatasi ed è conosciuto come inibitore di suicidio. Gli inibitori di tipo 2 anastrozolo e letrozolo si legano reversibilmente all’aromatasi. Vedere la FIGURA 1 per le strutture chimiche dei diversi AIS.
Meccanismo di Azione
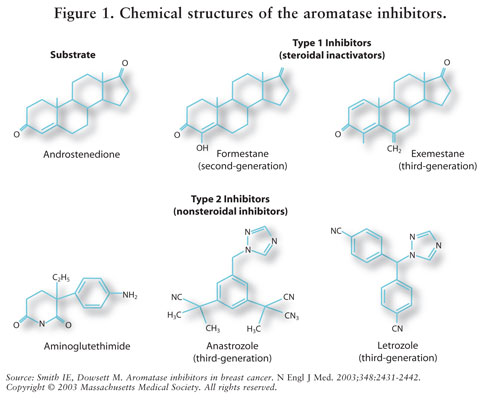
La sintesi di estrogeni è mediata dall’enzima aromatasi.7 Aromatasi converte androstenedione e testosterone in estrone ed estradiolo.5,7 AIs riducono l’estrogeno nelle donne in postmenopausa, inibendo così il suo effetto cancerogeno sul tessuto mammario.7 Poiché le ovaie delle donne in premenopausa sono ancora funzionanti, gli AIS non sono indicati per questa popolazione al di fuori degli studi clinici; in queste donne, gli AIs stimolerebbero l’ipotalamo e l’ipofisi ad aumentare la produzione di gonadotropine.4 Vedere FIGURA 2.
Tossicità6,8
Gli effetti avversi dell’AIs includono disfunzioni cardiovascolari come ipertensione, vasodilatazione, edema e dolore toracico. Sono necessari ulteriori studi per valutare il pieno effetto dell’AIs sulla funzione cardiaca. I pazienti possono manifestare diminuzione della densità minerale ossea (BMD), aumento del rischio di frattura, sintomi vasomotori, secchezza vaginale, dolore muscoloscheletrico, mal di testa, insonnia, depressione, aumento della tosse, dispnea, disturbi gastrointestinali, aumento di peso e possibilmente elevati livelli lipidici. La perdita ossea è un effetto collaterale predominante; i bifosfonati come l’acido zoledronico sono stati usati per contrastarlo. I pazienti trattati con AIs devono ricevere integratori di vitamina D e calcio. Gli effetti avversi prolungati e gli effetti sulla funzione cognitiva della terapia AI non sono ancora stati determinati.9 AIs sono controindicati nelle donne in gravidanza.
Interazioni farmacologiche
Anastrozolo inibisce CYP1A2, CYP2C9, e CYP3A4.10,11 Letrozolo è metabolizzato da CYP2A6 e CYP2C19, e exemestane metabolizza CYP3A4.8,10-13 induttori di CYP3A4 come rifampicina, fenitoina, carbamazepina, e erba di San Giovanni può causare una diminuzione dei livelli di exemestane quando somministrato in concomitanza. 8,12,13 Tamoxifene provoca una diminuzione del 38% nel letrozolo e una diminuzione del 27% nell’anastrozolo quando co-somministrato.2,7,8,14
Indicazioni e dosaggio
Anastrozolo 10,11: Anastrozolo 1 mg una volta al giorno è indicato per il cancro al seno precoce come terapia adiuvante iniziale nelle donne in postmenopausa con malattia ormonalmente sensibile e come prima linea per HR+ o HR-sconosciuto metastatico o malattia localmente avanzata. Inoltre è approvato per l’uso dopo la terapia con tamoxifene nelle donne con malattia progressiva. Non è necessario un aggiustamento della dose in caso di insufficienza renale o insufficienza epatica da lieve a moderata.
Letrozole11,12: Letrozolo 2.5 mg una volta al giorno è indicato per le donne in postmenopausa con carcinoma mammario HR + in fase iniziale come terapia iniziale o come terapia adiuvante estesa dopo tamoxifene. Inoltre è indicato per la malattia metastatica HR+ o HR-sconosciuta. Si raccomandano aggiustamenti della dose in caso di insufficienza epatica grave.
Exemestane11,14: Exemestane 25 mg po una volta al giorno è indicato come terapia adiuvante due o tre anni dopo tamoxifene per le donne in postmenopausa con carcinoma mammario precoce HR+, per un totale di cinque anni consecutivi di terapia ormonale. Può anche essere usato per la malattia che ha progredito dopo la terapia con tamoxifene. Dovrebbe essere preso dopo un pasto. Aggiustamento della Dose è necessaria per insufficienza epatica o renale
Studi Clinici
Tamoxifen tossicità correlate come il cancro dell’endometrio viene chiesto l’avvio di studi clinici su larga scala per indagare l’uso di terza generazione AIs nelle donne in postmenopausa con HR+ cancro al seno. Vari progetti di prova sono stati utilizzati per valutare le prestazioni di questi agenti rispetto al tamoxifene.6 Risultati superiori in termini di efficacia clinica e profili di tossicità hanno stabilito l’AIs come nuovo standard di terapia adiuvante nelle donne in postmenopausa con carcinoma mammario HR+.6
ATAC15: ATAC (Arimidex, tamoxifene da solo o in combinazione), uno studio multicentrico, randomizzato, in doppio cieco, ha confrontato tre bracci di trattamento: tamoxifene 20 mg + anastrozolo placebo, anastrozolo 1 mg + tamoxifene placebo e una combinazione di tamoxifene 20 mg + anastrozolo 1 mg. L’obiettivo primario era quello di valutare la sicurezza e l’efficacia di tamoxifene contro anastrozolo e la combinazione di anastrozolo e tamoxifene in cinque anni. Un totale di 9.366 pazienti-3.125 nel braccio anastrozolo, 3.116 nel braccio tamoxifene e 3.125 nel braccio combinato-sono stati trattati per una mediana di 33 mesi.
Dopo tre anni, anastrozolo ha dimostrato DFS dell ‘89,4% rispetto all’ 87,4% per tamoxifene (hazard ratio 0,83, 95% CI , P =.013). Anastrozolo diminuito il tasso di cancro al seno controlaterale (CLBC) rispetto al tamoxifene (odds ratio 0,42, 95% CI , P =.007). Il braccio di combinazione è stato chiuso perché non è stato riscontrato alcun beneficio clinico oltre al tamoxifene. L’anastrozolo è stato associato ad effetti avversi come il cancro dell’endometrio (P =.02), sanguinamento vaginale, scarico (P <.0001), eventi cerebrovascolari (P =.0006), eventi tromboembolici venosi (P =.0006), e vampate di calore (P <.0001); il tamoxifene è stato associato a meno fratture e meno dolori articolari (P <.0001). Dopo 68 mesi, l’anastrozolo ha aumentato la DFS (HR 0,87, 95% CI, P =.01) e tempo alla ricorrenza (HR 0,79, IC 95%, P =.0005) e diminuzione delle metastasi a distanza (HR 0,86, IC al 95%, P =.04) e CLBC (diminuzione del 42%, P =.01).Dopo un intervallo mediano di follow-up di 100 mesi, i pazienti HR + trattati con anastrozolo hanno dimostrato miglioramenti nella DFS (HR 0,85; P =.003), presenza di CLBC (HR 0,60, P =.004), tempo di ricorrenza (HR 0.76, P =.0001), e il tempo di ricorrenza a distanza (HR 0.84, P =.022) rispetto ai pazienti trattati con tamoxifene. La differenza assoluta nei tassi di recidiva è migliorata da 2.8% dopo cinque anni al 4,8% dopo nove anni. I tassi di frattura dell’anastrozolo erano più alti durante la terapia, ma la differenza è diminuita sostanzialmente dopo il periodo di follow-up di 100 mesi. Il periodo di terapia prolungata presentava un rischio di frattura di 1,15 con anastrozolo rispetto a 1,02 con tamoxifene. Il rischio di cancro endometriale è stato ridotto durante e fuori la terapia con anastrozolo rispetto al tamoxifene, con un tasso annuale di 0,043 contro 0,14 e 0,014 contro 0,12, rispettivamente. Non è stata identificata una differenza nella sopravvivenza globale (OS).
MA.1712,17: MA.17 era uno studio randomizzato, controllato con placebo, in doppio cieco che valutava l’efficacia di cinque anni di terapia con letrozolo in donne in postmenopausa con cancro al seno che avevano già completato cinque anni di terapia adiuvante con tamoxifene. I pazienti hanno ricevuto letrozolo 2,5 mg o placebo al giorno per cinque anni. L’endpoint primario era DFS; gli endpoint secondari erano qualità della vita, profilo di sicurezza esteso e sistema operativo. Dei 5.187 pazienti, 2.593 hanno ricevuto letrozolo e 2.594 hanno ricevuto placebo; il follow-up mediano è stato di 2,4 anni.
Nell’analisi preliminare c’erano 207 recidive locali o metastatiche di cancro al seno o neoplasie maligne iniziali di CLBC, 75 nel gruppo letrozolo e 132 nel gruppo placebo. I tassi di DFS previsti a quattro anni per i due gruppi erano rispettivamente del 93% e dell ‘ 87% (P ?.001 per la valutazione del DFS). Nel braccio a letrozolo, DFS aveva un’ora di 0,61 (95% CI , P ?.001). Il letrozolo ha dimostrato una diminuzione del 43% dell’incidenza del cancro al seno (HR 0,57, IC al 95%, P =.00008).4 Ad eccezione dei pazienti nodo-positivi (P =.04), il sistema operativo non ha raggiunto la significatività statistica (HR 0.82, P =.30).4 Pazienti nel braccio del letrozolo hanno avvertito i sintomi vasomotori di basso grado, la mialgia e l’artrite. L’osteoporosi è stata più comune (anche se non significativamente) nel braccio con letrozolo rispetto al placebo (5,8% vs. 4,5%; P =.07), e i tassi di frattura erano comparabili tra le braccia. Lo studio è stato chiuso dopo una mediana di 2,4 anni a causa di una diminuzione degli eventi di cancro al seno nel braccio del letrozolo. La terapia adiuvante estesa con letrozolo dopo il completamento di cinque anni di tamoxifene ha migliorato la DFS.
BIG 1-987, 9, 18: Lo studio Breast International Group (BIG) 1-98, uno studio in doppio cieco, multicentrico, randomizzato, ha arruolato 8.028 donne in postmenopausa con carcinoma mammario HR+ in stadio precoce. Lo studio comprendeva quattro bracci di trattamento che hanno valutato cinque anni di monoterapia con tamoxifene, cinque anni di monoterapia con letrozolo, tamoxifene per due anni, quindi un passaggio al letrozolo per tre anni, o letrozolo per due anni, quindi un passaggio al tamoxifene per tre anni. L’obiettivo primario era DFS; gli obiettivi secondari erano il tempo di metastasi a distanza, la sicurezza e il sistema operativo. La DFS è aumentata nei pazienti che hanno ricevuto letrozolo rispetto a quelli che hanno ricevuto tamoxifene (HR 0,81, IC al 95%, riduzione relativa 19%, P =.003), con una differenza assoluta dell ‘ 1,5% a tre anni. Il tamoxifene ha aumentato il verificarsi di eventi tromboembolici rispetto al letrozolo (O 0,38, P <.0001). Le fratture ossee sono state aumentate nel braccio del letrozolo (O 1,44, P =.006).
IES14, 19: Lo IES (studio intergruppo Exemestane) era uno studio randomizzato, in doppio cieco, multicentrico, di fase III il cui obiettivo era determinare se il passaggio a exemestane dopo due o tre anni di tamoxifene fosse più efficace del continuare il tamoxifene per cinque anni. Lo studio ha arruolato 4.742 donne in postmenopausa randomizzate in due bracci di trattamento; 2.362 soggetti sono stati programmati per passare a exemestane 25 mg po qd dopo due o tre anni di tamoxifene 20 mg po qd per completare cinque anni di terapia, e i restanti 2.380 sono stati programmati per ricevere tamoxifene 20 mg po qd per cinque anni. DFS era l’endpoint primario; gli endpoint secondari erano OS, profilo di tossicità esteso e frequenza di CLBC.
Gli eventi avversi, che si sono verificati su una mediana di 30,6 mesi, hanno incluso frequenza di CLBC, recidiva locale o metastatica e morte. Ci sono stati 449 eventi 1 183 nel braccio exemestane e 266 nel braccio tamoxifene. Il braccio exemestane aveva un HR non regolato di 0,68 (95% CI, P <.001 dal log-rank test), che ha dimostrato una diminuzione del rischio del 32% ed è stato analogo a un vantaggio in DFS di 4.75 (95% IC) a tre anni. Dopo tre anni, il braccio exemestane aveva un DFS del 91,5% (95% CI ) rispetto all ‘ 86,8% (95% CI) nel braccio tamoxifene. Non c’era differenza significativa nell’OS fra i due gruppi, con 93 morti nel braccio di exemestane e 106 morti nel braccio di tamoxifene. C’era una differenza significativa nella frequenza di CLBC (P =.04) subjects 20 soggetti nel braccio tamoxifene e nove nel braccio exemestane. L’uso di exemestane per completare i cinque anni di trattamento dopo due o tre anni di tamoxifene ha migliorato DFS rispetto a cinque anni di tamoxifene.
Prevenire la perdita ossea da AI Therapy20
Le donne in postmenopausa sono inclini a sviluppare una diminuzione della BMD a causa dei ridotti livelli di estrogeni. La terapia AI nel paziente con cancro al seno in postmenopausa aggrava questa tendenza. Denosumab, un anticorpo sperimentale monoclonale completamente umano, lega l’attivatore del recettore per il ligando del fattore nucleare kB (RANKL) e previene l’attività del RANKL. RANKL è vitale per l’attività osteoclastica, il che significa la rottura dell’osso. Denosumab e risedronato, un bifosfonato, sono in fase di valutazione per la loro capacità di contrastare la perdita ossea associata alla terapia AI.
Denosumab Study20: Uno studio multicentrico, randomizzato, di fase III ha valutato l’uso di denosumab 60 mg somministrato per via sottocutanea una volta ogni sei mesi in donne in postmenopausa che assumevano AIs per HR+ carcinoma mammario non metastatico. L’obiettivo era valutare la variazione della BMD lombare-spinale dal basale a 12 mesi. Dei 252 pazienti, 127 sono stati assegnati al denosumab e 125 al placebo. Entrambi i bracci hanno ricevuto calcio e vitamina D. La BMD è stata valutata mediante assorbimetria a raggi X a doppia energia. Dopo 12 e 24 mesi di terapia con denosumab o placebo, c’è stata una differenza del 5,5% e del 7,6%, rispettivamente, nell’aumento della BMD nella regione lombare-spinale a favore di denosumab (P <.0001 per entrambi i mesi). Denosumab ha dimostrato un profilo di tossicità comparabile rispetto al placebo. La terapia con Denosumab per più di 24 mesi non è stata ancora valutata.
IBIS-II Bone Sub-Study21: L’International Breast Cancer Intervention Study-II (IBIS-II) Bone Sub-Study è stato derivato da IBIS-II, che ha valutato le donne in postmenopausa con una maggiore probabilità di sviluppare il cancro al seno che sono stati randomizzati ad anastrozolo o placebo per cinque anni. Il substudio, con un arruolamento attuale di 700 pazienti, sta valutando risedronato rispetto a placebo per la prevenzione della perdita di BMD in donne con bassi punteggi T al basale. Un sottoinsieme di pazienti dello studio IBIS-II è stato assegnato a una delle tre diverse strategie di trattamento nel sotto-studio. Dopo un anno di terapia, 350 pazienti con anastrozolo e 350 pazienti con placebo di IBIS-II hanno ricevuto risultati di substudy. Lo strato 1 comprendeva 227 pazienti trattati con anastrozolo con T-score normali (T-score ?1), lo strato 2 comprendeva 80 pazienti con osteopenia (ñ2.5 ? T-score <1) che sono stati assegnati a risedronato 35 mg una volta a settimana o placebo, e lo strato 3 comprendeva 43 pazienti con osteoporosi (ñ4 <T-score <2,5) che sono stati assegnati a risedronato 35 mg una volta a settimana.
Per i pazienti con osteopenia o osteoporosi al basale, il risedronato sembrava inibire la perdita ossea associata all’anastrozolo. Nello strato II, risedronato ha dimostrato effetti favorevoli sulla conservazione della BMD per l’anca totale ma non per la colonna lombare (P =.005 e P =.15, rispettivamente, vs. placebo). Non sono stati associati effetti avversi gravi o interazioni farmacologiche con risedronato.
Studio di AIs in donne in premenopausa (SOFT) 21-26
Circa il 33% delle donne di età inferiore ai 50 anni sarà diagnosticato un cancro al seno invasivo. 22 Lo studio di soppressione della funzione ovarica (SOFT, IBCSG 24-02, BIG 2-02) sta studiando l’uso della terapia AI nelle donne in premenopausa con carcinoma mammario HR+. Lo studio, che ha un arruolamento mirato di 3.000 pazienti, coinvolge donne in premenopausa con carcinoma mammario HR + che hanno completato la chemioterapia o che hanno ricevuto solo un intervento chirurgico. L’ablazione ovarica è stabilita attraverso la somministrazione di triptorelina (un ormone di rilascio delle gonadotropine) una volta al mese per cinque anni, ooforectomia chirurgica o irradiazione pelvica. I pazienti saranno randomizzati a uno dei tre bracci, con il primo braccio che riceve tamoxifene una volta al giorno per cinque anni, il secondo braccio che riceve tamoxifene per cinque anni in combinazione con ablazione ovarica e il terzo braccio che riceve exemestane per cinque anni in combinazione con ablazione ovarica. I pazienti riceveranno exemestane o tamoxifene per cinque anni.
Prove di Chemioprevenzione23-27
Il tamoxifene è indicato per la chemioprevenzione del cancro al seno.6 Il suo profilo di tossicità è una causa di costrizione per quanto riguarda l’uso terapeutico.6 L’AIs può ridurre l’incidenza di carcinoma mammario HR+ in pazienti ad alto rischio a causa di una diminuzione dell’incidenza di CLBC rispetto al tamoxifene negli studi clinici come ATAC.6
Gli studi di chemioprevenzione AI includono l’International Breast Cancer Study Group (IBCSG) trial 31-03 (IBCSG 31-03) e il National Cancer Institute of Canada’s MAP.3 di prova. L’obiettivo primario dello studio multicentrico, internazionale, randomizzato, controllato con placebo IBCSG 31-03 è quello di valutare l’uso di anastrozolo per la prevenzione del cancro al seno nelle donne in postmenopausa. La sua misura primaria di risultato è l’incidenza di cancro al seno invasivo e non invasivo; la misura secondaria di risultato è l’incidenza di osteoporosi e fratture.5 La prova IBCSG 31-03 ha un target di iscrizione di 6.000. mappa.3 trial valuta exemestane come agente chemiopreventivo nelle donne in postmenopausa. L’obiettivo primario della MAPPA controllata con placebo.3 lo studio è quello di valutare l’efficacia di exemestane nel ridurre l’incidenza del cancro al seno invasivo.
Potenziali usi futuri: Case Report
Il letrozolo è stato utilizzato dopo il fallimento del clomifene per indurre la fertilità in 22 donne con sindrome dell’ovaio policistico. Letrozolo ha indotto l’ovulazione nel 75% dei cicli contro il 44,4% dei cicli indotti dal clomifene. Quattro gravidanze sono il risultato delle ovulazioni indotte dal letrozolo e nessun effetto avverso significativo è stato associato al letrozolo.28,29
Una donna obesa di 57 anni con endometriosi a seguito di isterectomia e salpingo-ooforectomia bilaterale ha ricevuto anastrozolo dopo terapia con megestrol. Il paziente non ha avuto lesioni endometriali dopo nove mesi.28,30
A un paziente con sindrome di McCune-Albright è stato somministrato anastrozolo per la pubertà precoce; l’estradiolo del paziente si è normalizzato dopo 2,5 anni di anastrozolo e l’età ossea è avanzata di sei mesi.28,31 L’aumento dell’estrogeno può indurre ginecomastia e ipogonadismo ipogonadotropico.28,31 Diminuendo l’estrogeno con un’IA ha provocato la gonadotropina normale e il testosterone in maschi con ginecomastia e ipogonadismo ipogonadotropico. 28,31,32
Il letrozolo è stato studiato in pazienti con carcinoma ovarico recidivato; quei pazienti che hanno ricevuto letrozolo hanno avuto una stabilizzazione della malattia.28,33 letrozolo neoadiuvante è stato somministrato a 10 donne in postmenopausa con carcinoma endometriale; il farmaco ha dimostrato cambiamenti clinici costruttivi e non ha avuto alcun impatto chirurgico negativo.28,34
Quando il trattamento con testolattone contro anastrozolo è stato confrontato in uomini infertili, l’efficacia dei due agenti è stata simile.28,35 Pazienti con sindrome di Klinefelter hanno avuto un trattamento più efficace con testolattone che con anastrozolo.28,35
Conclusioni
Le IA di terza generazione hanno mostrato una DFS superiore nelle donne in postmenopausa con carcinoma mammario HR+, ma il beneficio clinico di oltre cinque anni di terapia con IA in queste pazienti non è stato stabilito.4 Il National Surgical Adiuvant Breast and Bowel Project (NSABP) B-33 (exemestane) trial e una successiva randomizzazione del MA.17 (letrozolo) studio esaminerà l’uso di questi AIs rispetto al placebo per altri cinque anni.4 Le AIS sono un’alternativa appropriata per le donne HR + postmenopausali in cui il tamoxifene è controindicato.4
Gli effetti benefici dell’IA di terza generazione includono un profilo di tossicità più tollerabile e un DFS superiore rispetto al tamoxifene. Il livello di efficacia tra questi agenti e tamoxifene è paragonabile. Permane incertezza per quanto riguarda la durata selezionata della terapia, il profilo di tossicità a lungo termine e la sequenza appropriata di somministrazione per l’AIs.4 Nuovi studi sono necessari per produrre modulatori selettivi dell’aromatasi che produrranno meno tossicità rispetto all’AIs.25,36 – 37
1. Robertson JFR. Fulvestrant (FaslodexÆ) how come fare un buon farmaco migliore. Oncologo . 2007;12:774-784.
2. Osborne CK. Terapia farmacologica: tamoxifene nel trattamento del cancro al seno. N Ingl J Med. 1998;339:1609-1618.
3. National Cancer Comprehensive Network. NCCN linee guida di pratica clinica in oncologia v v. 1. 2008. Cancro al seno. www.nccn.org/professionals/physician_gls/f_guidelines.asp. Accesso 11 ottobre 2007.
4. I nostri servizi sono sempre a portata di mano. American Society of Clinical Oncology technology assessment on the use of aromatase inhibitors as adiuvant therapy for postmenopausal women with hormone receptor-positive breast cancer: status report 2004. J Clin Oncol . 2005;23:619-629.
5. Per maggiori informazioni:
6. Smith IE, Dowsett M. Inibitori dell’aromatasi nel cancro al seno. N Ingl J Med. 2003;348:2431-2442.
7. Goss PE, Strasser K. Inibitori dell’aromatasi nel trattamento e nella prevenzione del cancro al seno. J Clin Oncol . 2001;19:881-894.
8. Lacy CF, Armstrong LL, Goldman MP, et al, eds. Drug Information Handbook. 13a ed. Hudson, OH: Lexi-Comp; 2005: 117,598,871.
9. Ellis MJ, ed. Inibitori dell’aromatasi per il trattamento del cancro al seno. Manhasset, NY: Oncology Publishing Group, CMP Healthcare Media; 2005:29-45.
10. Foglietto illustrativo di Arimidex (anastrozolo). Wilmington, DE: AstraZeneca Pharmaceuticals LP; Maggio 2007.
11. Arora A, Potter JF. Aromatase inhibitors: current indications and future prospects for treatment of postmenopausal breast cancer. J Am Geriatr Soc. 2004;52:611-616.
12. Femara (letrozole) package insert. East Hanover, NJ: Novartis Pharmaceuticals Corp; December 2006.
13. Shaw G. In preventing breast cancer occurrence…anastrozole beats tamoxifen in ATAC. Clin Oncol News . 1/2008. www.clinicaloncology.com/index.asp?ses=ogst§ion_id=148&mostra=rep&article_id=9884. Accesso 17 marzo 2008.
14. Aromasin (exemestane) foglietto illustrativo. New York, New York: Pfizer Inc; Febbraio 2007.
15. Baum M, Budzar AU, Cuzick J, et al, per il gruppo ATAC Trialists’. Anastrozolo da solo o in combinazione con tamoxifene versus tamoxifene da solo per il trattamento adiuvante di donne in postmenopausa con carcinoma mammario precoce: primi risultati dello studio randomizzato ATAC. Lancet. 2002;359:2131-2139.
16. Howell A, Cuzick J, Baum M, et al, per il gruppo ATAC Trialists’. Risultati dello studio ATAC (Arimidex, tamoxifene, da solo o in combinazione) dopo il completamento del trattamento adiuvante di 5 anni per il cancro al seno. Lancet. 2005;365:60-62.
17. Goss PE, Ingle JN, Martino S, et al. Uno studio randomizzato di letrozolo in donne in postmenopausa dopo cinque anni di terapia con tamoxifene per il cancro al seno in fase iniziale. N Ingl J Med. 2003;349:1793-1802.
18. Thrlimann B, Keshaviah A, Coates AS, et al, per il gruppo internazionale seno (GRANDE) 1-98 Gruppo collaborativo. Un confronto tra letrozolo e tamoxifene nelle donne in postmenopausa con cancro al seno precoce. N Ingl J Med. 2005;353:2747-2757.
19. Coombes RC, Hall E, Gibson LJ, et al, per lo studio intergruppo Exemestane. Uno studio randomizzato di exemestane dopo due o tre anni di terapia con tamoxifene in donne in postmenopausa con cancro al seno primario. N Ingl J Med. 2004; 350:
1081-1092.
20. Ellis G, Bone HG, Chlebowski R, et al. Uno studio di fase 3 sull’effetto della terapia con denosumab sulla densità minerale ossea in donne che ricevono inibitori dell’aromatasi per il cancro al seno non metastatico. Paper presentato a: il 30 ° annuale San Antonio Breast Cancer Symposium; Dicembre 13-16, 2007; San Antonio, TX. Riassunto 47.
21. I nostri servizi sono a vostra disposizione. Effetto dell’anastrozolo sulla densità minerale ossea dopo un anno di trattamento: risultati del sub-studio osseo dell’International Breast Cancer Intervention Study (IBIS-II). Relazione presentata a: il 30 ° annuale San Antonio Breast Cancer Symposium; Dicembre 13-16, 2007; San Antonio, TX. Riassunto 28.
22. Dellapasqua S, Colleoni M, Gelber RD, Goldhirsch A. Terapia endocrina adiuvante per le donne in premenopausa con carcinoma mammario precoce. J Clin Oncol. 2005;23:1736-1750.
23. Istituto Nazionale del Cancro. Trattamento del cancro al seno (PDQ). www.cancer.gov/cancertopics/pdq/treatment/breast/healthprofessional. Accesso 26 dicembre 2007.
24. Baylor College of Medicine Studi clinici. Soppressione della funzione ovarica Trial (SOFT). www.breastcenter.tmc.edu/clinic/trials/soft.htm. Accesso 26 dicembre 2007.
25. Aebi S, Castiglione – Gertsch M. Terapia endocrina adiuvante per pazienti molto giovani. Seno. 2003;12:509-515.
26. ClinicalTrials.gov. Soppressione della funzione ovarica più tamoxifene o exemestane rispetto al tamoxifene da solo nel trattamento delle donne in premenopausa con cancro al seno reattivo agli ormoni. www.clinicaltrials.gov/. Accesso 26 dicembre 2007.
27. Cuzick J. Inibitori dell’aromatasi per la prevenzione del cancro al seno. J Clin Oncol. 2005;23:1636-1643.
28. Karaer O, Oruá S, Koyuncu FM. Inibitori dell’aromatasi: possibili applicazioni future. Acta Obstet Gynecol Scand. 2004:83:699-706.
29. MF, Casper RF. Uso di un inibitore dell’aromatasi per l’induzione dell’ovulazione in pazienti con una risposta inadeguata al citrato di clomifene. Fertil Steril. 2001;75:305-309.
30. Bulun SE, Yang S, Fang Z, et al. Ruolo dell’aromatasi nella malattia endometriale. J Steroide Biochem Mol Biol. 2001;79:19-25.
31. Il suo nome deriva dal greco antico. Uso degli inibitori di aromatasi nella pubertà precoce. Cancro Endocr Relat. 1999;6:303-306.
32. Shozu M, Sebastian S, Takayama K, et al. Eccesso di estrogeni associato a nuove mutazioni del guadagno di funzione che interessano il gene dell’aromatasi. N Ingl J Med. 2003;348:1855-1865.
33. Il suo nome deriva dal greco antico, “Gab”, “Gab”, “Gab”, “Gab”, “Gab”, “Gab”. La risposta di CA 125 è associata con espressione del ricevitore dell’estrogeno in una prova di fase II del letrozolo in cancro ovarico: identificazione di un sottogruppo sensibile al sistema endocrino. Clin Cancer Res. 2002;8:2233-2239.
34. Berstein L, Maximov S, Gershfeld E, et al. Terapia neoadiuvante del cancro endometriale con letrozolo inibitore dell’aromatasi: effetti endocrini e clinici. Eur J Obstet Gynecol Reprod Biol. 2002;105:161-165.
35. Raman JD, Schlegel PN. Inibitori dell’aromatasi per l’infertilità maschile. J Urol. 2002;167:624-629.
36. Simpson ER, Dowsett M. Aromatasi e suoi inibitori: significato per la terapia del cancro al seno. Recent Prog Horm Res. 2002;57: 317-338.