C’è spesso molta confusione sul significato di “unità enzimatiche”, “attività enzimatica” e “attività enzimatica specifica”. Questa guida spiega questi concetti chiave in termini semplici e discute la progettazione del dosaggio enzimatico e l’importanza di operare nella “gamma lineare”. Consideriamo anche le curve standard e se si dovrebbe tracciare la concentrazione o la quantità assoluta di prodotto sull’asse x. Alcuni suggerimenti su come impostare i controlli di analisi e sottrarre gli spazi vuoti sono discussi. Infine, spieghiamo come vengono calcolati i valori di attività enzimatica e diamo una semplice panoramica delle equazioni cinetiche.
- Definizioni di unità enzimatiche
- Che cos’è l ‘ “attività enzimatica”
- Che cos’è l’attività enzimatica specifica?
- Fattori che influenzano l’attività enzimatica
- Sviluppare saggi e l’importanza della gamma lineare
- Tempo di dosaggio e temperatura
- Volume/sensibilità del dosaggio
- Analisi continue (misurazione dell’aspetto del prodotto nel tempo)
- Quale concentrazione di substrato dovrei usare?
- Curve standard
- Traccio Concentrazione o Quantità assoluta sull’asse X?
- Controlli e sottrazione di dati “vuoti”
- Calcolo dei valori di attività
- Inibizione enzimatica / Screening del farmaco
- Sommario
Definizioni di unità enzimatiche
L’enzimologia sarebbe meno complicata se tutti usassero la stessa definizione di unità. Di seguito viene fornita una definizione unitaria standard:
1 unità (U) è la quantità di enzima che catalizza la reazione di 1 umol di substrato al minuto (definizione A).
Nella maggior parte delle impostazioni R&D, 1 umol di substrato è in realtà un bel po ‘ di materiale e altre definizioni possono essere preferite per evitare di esprimere quantità in frazioni di unità. La seguente definizione non standard è comunemente usata:
1 unità (U) è la quantità di enzima che catalizza la reazione di 1 nmol di substrato al minuto (definizione B).
Si noti che il cambiamento nella definizione ha un profondo effetto sul numero dichiarato di unità cioè 1 unità di enzima secondo la definizione A equivarrebbe a 1000 unità secondo la definizione B!
Puoi anche vedere unità enzimatiche espresse come milli-unità (o mU) che significa semplicemente un millesimo di unità, indipendentemente da come l’unità è stata definita.
Chiaramente la quantità effettiva di un enzima in un tubo non viene alterata semplicemente cambiando la definizione dell’unità, ma è necessaria attenzione quando si confrontano le attività di campioni provenienti da diversi fornitori. Finché vengono fornite le definizioni delle unità, è possibile trasformare il numero dichiarato di unità in nmol per min, che non è ambiguo e consente di effettuare confronti validi.
Per chiarezza nel tuo lavoro potresti preferire usare ‘nmol per min’ (o ‘umol per min’), anche se se è richiesta una ripetizione costante, chiaramente il termine molto più breve ‘unità’ ha le sue attrazioni.
Che cos’è l ‘ “attività enzimatica”
L’attività è quotata in unità per ml (U / ml), in altre parole nmol per min per ml (se è stata adottata la definizione di unità B). Pertanto, i valori di attività espressi in unità sono anche soggetti a un illusorio “aumento” di 1000 volte se si passa dalla definizione di unità A alla definizione di unità B. Ancora una volta non ci può essere alcuna confusione se l’attività è espressa in termini di nmol per min per ml piuttosto che in unità per ml.
Poiché l’attività si riferisce alla concentrazione, ne consegue che due fiale di enzima possono contenere lo stesso numero di unità (in totale) ma hanno attività diverse (concentrazioni).
Che cos’è l’attività enzimatica specifica?
L’attività enzimatica specifica (di solito indicata semplicemente come “attività specifica”) è il numero di unità enzimatiche per ml diviso per la concentrazione di proteine in mg/ml. I valori di attività specifici sono quindi indicati come unità / mg o nmol / min / mg (se viene applicata la definizione di unità B).
L’attività specifica è una misura importante della purezza enzimatica e i valori per diversi lotti di un enzima puro dovrebbero essere gli stessi, all’interno del normale errore sperimentale.
Le diluizioni seriali di una soluzione enzimatica avranno valori di attività enzimatica diversi, ma valori di attività specifici identici perché nel calcolo dell’attività specifica il numeratore (unità/ml) e il denominatore (mg / ml) sono influenzati ugualmente dalla diluizione del campione.
Sebbene l’attività specifica sia molto diversa dall’attività, il calcolo dell’attività specifica dipende comunque dal valore dell’attività, e quindi il valore dell’attività specifica dichiarato dipenderà anche dalla definizione dell’unità enzimatica. I lotti che sono al di sotto del valore di attività specifico previsto possono contenere impurità o molecole enzimatiche che sono diventate denaturate.
Fattori che influenzano l’attività enzimatica
In questa sezione discutiamo perché un enzima può avere diversi valori di attività misurati in diversi laboratori. Con ciò intendiamo differenze reali nell’attività misurata, non differenze apparenti causate dall’uso di diverse definizioni di unità.
Le condizioni in cui viene eseguito un test influenzeranno i valori di attività riportati. Per esempio, i dosaggi sono in genere eseguite ad una temperatura tra 20-37°C. in generale, un enzima sarà più attivo a 37°C rispetto a 20°C.
La definizione dell’enzima unità sarebbe meglio espresso così:
1 unità (U) è la quantità se l’enzima che catalizza la reazione di 1 nmol di substrato al minuto in condizioni standard.
Sfortunatamente, il termine ‘condizioni standard’ è aperto all’interpretazione e potrebbero esserci diverse preferenze dell’utente, almeno negli ambienti R&D. Quindi dieci diversi laboratori di ricerca possono (abbastanza correttamente) calcolare attività diverse per la stessa soluzione di enzima. La maggior parte dei laboratori di ricerca stabilisce le proprie “condizioni standard” e controlla ogni nuovo lotto internamente. Nelle impostazioni cliniche le “condizioni standard” sono definite esplicitamente e tutti i laboratori sono tenuti a eseguire saggi identici.
Sviluppare saggi e l’importanza della gamma lineare
Il valore di attività (unità / ml) per il vostro enzima è il parametro più importante quando si sta sviluppando un saggio. Questo perché il volume (cioè il numero di unità) che si aggiunge determinerà la quantità di substrato che viene convertito in prodotto. Ricorda, 1 unità catalizza la conversione di 1 nmol di substrato al minuto (definizione B).
Le unità/ml riportate possono darvi un’idea approssimativa della quantità di enzima da aggiungere, ma poiché il valore di attività potrebbe non essere stato determinato in un test identico al vostro, è usuale preparare diluizioni seriali dell’enzima (ad es. diluizioni log inizialmente) e testare un volume fisso di ciascuna diluizione. A seconda del segnale del test (che sarà correlato alla quantità di substrato convertito) può essere necessario un secondo esperimento per eseguire una diluizione adeguata.
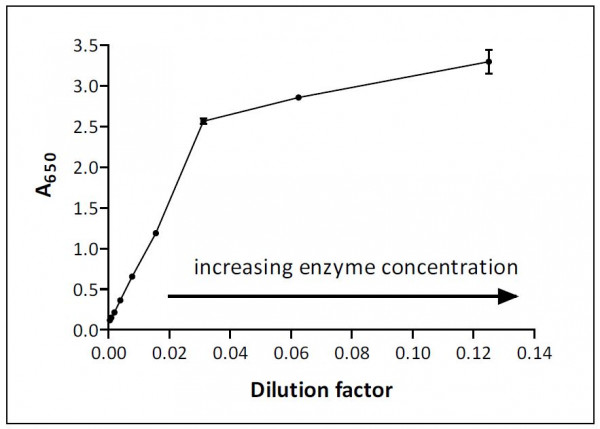
Qual è esattamente la diluizione “migliore”? Per rispondere a questo, dobbiamo pensare all’aspetto più importante del design del dosaggio: la gamma lineare. È importante che il lavoro quantitativo funzioni in un intervallo in cui un diagramma del segnale di analisi (spesso assorbanza) rispetto alla concentrazione enzimatica è lineare. La maggior parte dei saggi sono lineari se il grado di conversione del substrato è inferiore al 15%, supponendo che non ci siano altri fattori limitanti. Fissando il tempo di dosaggio (ad esempio 30 min) e la temperatura (ad esempio 25oC), il grado di conversione può essere controllato semplicemente regolando un parametro, ovvero il numero di unità enzimatiche aggiunte.
Questo è illustrato graficamente nella Figura 1 con diluizioni espresse come reciproci (cioè diluizione di 1/10 = 0,1 sull’asse x). La tua trama può differire nella sua forma e gamma lineare, ma ad altissima concentrazione enzimatica senza dubbio il segnale di analisi non aumenterà in proporzione alla quantità di enzima aggiunto.
Il dosaggio in Figura 1 è lineare fino a densità ottica (OD) 2,5 e un fattore di diluizione di 0,02 (diluizione 1/50 dell’enzima) sarebbe ideale per il lavoro di analisi, in quanto fornisce un segnale ampio (~1,5) e si trova nel mezzo dell’intervallo lineare. I calcoli basati sui risultati per i fattori di diluizione nell’intervallo tra 0,04 e 0,12 (cioè la regione con pendenza ridotta) sottovaluteranno il vero livello di attività enzimatica perché qualcosa sta chiaramente limitando l’entità del segnale di analisi.
Molti fattori possono operare per limitare l’intervallo lineare e l’intervallo varierà da analisi a analisi. Un motivo comune per la non linearità è il consumo eccessivo di substrato, che può causare la caduta della velocità di reazione, ma le limitazioni dei componenti ottici del lettore di lastre (o qualsiasi altro dispositivo di misurazione utilizzato) possono anche essere significative. La maggior parte dei lettori di lastre, ad esempio, non può misurare in modo affidabile valori di assorbanza superiori a 3 e questa limitazione si applica indipendentemente dalla percentuale del substrato che è stato convertito in prodotto.

Fig 1. Assorbanza rispetto alla quantità di enzima
Anche se non altrimenti discusso in questa guida, si dovrebbe anche essere consapevoli del fatto che gli enzimi possono denaturare nel tempo, soprattutto se sono molto diluiti, e i prodotti di alcune reazioni possono inibire l’enzima. In effetti ci sono altre possibili ragioni per un comportamento non lineare, ma di solito è relativamente facile trovare l’intervallo lineare per tentativi ed errori usando diluizioni seriali dell’enzima come descritto sopra.
Tempo di dosaggio e temperatura
Questi parametri possono anche influenzare l’intervallo lineare in quanto influenzano il tasso di conversione del substrato. Ad esempio, un test può essere lineare dopo 15 minuti, ma a 60 minuti potrebbe essere stato consumato troppo substrato. In questa situazione si dovrebbe ridurre la quantità di enzima al fine di eseguire il test per 60 minuti. Le stesse considerazioni si applicano alla temperatura di dosaggio in quanto può anche influenzare la velocità di reazione.
La maggior parte delle persone adotta un tempo di analisi compreso tra 15 min e 60 min. Tempi molto brevi (ad esempio 2 min) devono essere evitati perché un leggero ritardo nell’arresto della reazione porterà ad un errore significativo nei calcoli dell’attività. È importante assicurarsi che i reagenti conservati in frigorifero o congelatore siano equilibrati alla temperatura corretta prima dell’uso, e ciò è particolarmente importante se si dispone di un tempo di analisi relativamente breve.
Volume/sensibilità del dosaggio
Dal punto di vista pratico il volume del dosaggio è determinato / limitato dall’elemento di consumo utilizzato per i test (ad esempio cuvette, tubi o micropiastre). Il segnale per la maggior parte dei saggi enzimatici è proporzionale al volume del saggio e i tentativi di miniaturizzare il saggio (ad esempio per conservare i reagenti) di solito portano a segnali più bassi. Tuttavia, i test di assorbanza sono spesso un’eccezione e un passaggio da una cuvetta da 3 ml a una micro-cuvetta da 1 ml, ad esempio, non cambierà la lettura dell’assorbanza se la larghezza (lunghezza del percorso) della cuvetta è ancora di 1 cm (cioè la luce passa ancora attraverso la stessa’ lunghezza ‘ del liquido). Questo perché l’assorbanza è proporzionale alla lunghezza del percorso, non al volume del campione.
Nei test di assorbanza micropiastre, la lunghezza del percorso è uguale alla profondità del liquido ed è possibile miniaturizzare senza perdita di segnale riducendo il diametro dei pozzetti e mantenendo una profondità costante del liquido. Ad esempio, 96 piastre ben possono facilmente ospitare 200ul di campione, ma con un volume di analisi 50ul sarebbe meglio utilizzare una piastra 384-well per aumentare la lunghezza del percorso rispetto a quella vista con 50ul di campione in una piastra 96 – well.
Analisi continue (misurazione dell’aspetto del prodotto nel tempo)
La maggior parte delle analisi viene eseguita per un periodo di tempo fisso (analisi del punto finale) e la reazione viene interrotta mediante l’aggiunta di un reagente di arresto (ad esempio acido). Tuttavia, nei test continui l’aspetto del prodotto (meno comunemente il consumo di substrato) viene registrato in modo continuo (ad es. per mezzo di un registratore grafico). Si applicano le stesse regole di base; un grafico del segnale rispetto al tempo per una quantità fissa di enzima dovrebbe essere lineare e la velocità dovrebbe raddoppiare se la quantità di enzima è raddoppiata. Fintanto che il saggio viene utilizzato nell’intervallo lineare, l’attività di “incognite” opportunamente diluite può essere determinata con precisione dalle velocità di reazione iniziali misurate con una serie di standard.
Quale concentrazione di substrato dovrei usare?
La concentrazione del substrato influenzerà la velocità di reazione, ma ci sono diversi fattori da considerare nella scelta della concentrazione “giusta”. Da un punto di vista pratico una considerazione fondamentale è la quantità di prodotto che deve essere generato al fine di dare un segnale di dosaggio misurabile. Poiché è probabile che la velocità di una reazione enzimatica diminuisca quando più del 15% circa del substrato è stato idrolizzato, la concentrazione iniziale del substrato dovrebbe generalmente essere almeno 10 volte la concentrazione del prodotto che è noto per fornire un segnale di dosaggio accettabile.
Un’altra considerazione è il Km per il substrato. Mentre l’aggiunta di più substrato generalmente significa che vedrai valori di attività più elevati, la relazione non è lineare e potrebbe essere necessario considerare il costo del substrato. A questo punto è probabilmente utile introdurre la classica equazione di Michaelis-Menten:
v = (Vmax S) / (Km + S) ……………. Eqn. (1)
dove v è la velocità, Vmax è la velocità massima possibile, S è la concentrazione del substrato e Km è uguale alla concentrazione del substrato che dà la metà dell’attività massima. La derivazione di questa equazione e le sue ipotesi sottostanti possono essere trovate in qualsiasi libro di testo sulla cinetica enzimatica. Sebbene sia normale misurare piuttosto che calcolare la velocità delle reazioni enzimatiche, è utile comprendere i principi sottostanti ai fini della progettazione del dosaggio.
L’equazione di Michaelis-Menten è utile in quanto aiuta a selezionare una concentrazione adeguata di substrato se il Km è noto.
Quando S = Km, v = (Vmax S)/2S, cioè v/Vmax = S/2S=½.
In altre parole, l’enzima opererà al 50% del tasso massimo possibile quando S=Km.
Sostituendo nell’equazione 1 i valori per S = 10 e Km = 1 vedrai che aumentando la concentrazione del substrato di 10 volte l’enzima ora funziona a ~90% di esso velocità massima possibile, invece di 50%. Chiaramente questo è più alto, ma non 10 volte più alto.
A concentrazioni molto elevate di substrato il Km nell’equazione 1 diventa numericamente insignificante e la velocità misurata è quindi uguale a Vmax.
Molti test vengono eseguiti con una concentrazione di substrato pari o intorno al valore Km, ma se il Km è molto alto potrebbe non essere possibile utilizzare una concentrazione di substrato così elevata (ad es. per ragioni di costo o di solubilità limitata).
In alcune situazioni può essere addirittura consigliabile utilizzare una concentrazione relativamente bassa di substrato. Ad esempio, nella scoperta di farmaci farmaceutici, l’uso di concentrazioni di substrato molto elevate renderebbe più difficile identificare gli inibitori enzimatici competitivi (gli inibitori competitivi si legano allo stesso sito del substrato).
Un equilibrio dei vari fattori deve essere raggiunto in modo che il saggio abbia un segnale misurabile, possa essere azionato nell’intervallo lineare e possa soddisfare qualsiasi altro obiettivo di saggio (ad esempio costo, tempo e così via).
Curve standard
Per calcolare l’attività enzimatica è sempre necessaria una curva standard. Non è essenziale se sei interessato solo ai valori di attività relativi.
La curva standard è costruita misurando il segnale di dosaggio con soluzioni standard del prodotto di reazione su un adeguato intervallo di concentrazioni. Idealmente dovresti eseguire una curva standard per ogni esperimento, ma se la curva standard è altamente riproducibile potrebbe essere accettabile eseguirla periodicamente.
Una tipica curva standard è mostrata nella Figura 2 qui sotto. Questa è una curva standard per un saggio di ATPasi, in cui l’ATP viene idrolizzato in ADP e Pi (fosfato inorganico).

Fig 2. Curva standard per Pi
Il fosfato viene rilevato mediante un reagente legante il colorante che cambia colore in presenza di fosfato. Tuttavia, le specifiche di questo test non sono importanti qui; qualunque sia la natura del prodotto o il metodo di rilevamento che viene utilizzato, una curva standard che mostra la dipendenza del segnale sulla quantità di prodotto nel saggio deve essere costruito. La “curva” (idealmente è una linea retta) viene utilizzata per determinare la quantità di prodotto generato in campioni con attività sconosciuta, ovvero dal valore di assorbanza, leggendo l’intercetta sull’asse x. (La maggior parte dei pacchetti software grafici calcolerà automaticamente i valori di x dai valori misurati di y). La quantità di attività può quindi essere calcolata (vedi più avanti).
Traccio Concentrazione o Quantità assoluta sull’asse X?
Qui non esiste un’unica risposta corretta e la possibilità di utilizzare entrambi gli approcci può spesso causare confusione quando vengono calcolati i valori di attività. Ad esempio, tracciare nmol del prodotto sull’asse x è molto conveniente se è necessario calcolare i valori di attività (ricorda, activity = nmol per min per ml). Tuttavia, i reagenti di laboratorio vengono solitamente preparati a concentrazioni note ed è spesso più facile tracciare questi valori sull’asse x. Tuttavia, quando si calcola l’attività (o attività specifica) del proprio enzima, è necessario ricordare di convertire la concentrazione sull’asse x nel numero di nmoli di prodotto formati, il che significa che è necessario tenere conto del volume del test. La ragione è facile da capire: i volumi 50ul e 100ul di una soluzione standard saranno alla stessa concentrazione, ma il volume più grande conterrà il doppio della quantità di prodotto. Generalmente, è meglio scegliere un approccio (cioè tracciare la quantità assoluta di prodotto o concentrazione) in modo che venga sempre utilizzato lo stesso metodo di calcolo dell’attività.
Controlli e sottrazione di dati “vuoti”
I controlli corretti sono di vitale importanza per il lavoro quantitativo, così come l’uso corretto dei dati di controllo nei calcoli.
I controlli indicano (indirettamente) quanto del segnale del test è dovuto all’azione dell’enzima e quanto si verifica per altri motivi. Una fonte comune di segnale “falso” è il substrato (che spesso può essere contaminato dal prodotto). Altri componenti del saggio possono anche dare origine a un piccolo segnale a seconda della natura dei componenti e del tipo di saggio. Lo scopo dei controlli è quello di consentire di rimuovere (per sottrazione) qualsiasi elemento del segnale totale che non sia correlato all’azione dell’enzima. Se il dosaggio è ben progettato e i reagenti di dosaggio sono di buona qualità, il trattamento dei controlli è di solito abbastanza semplice.
Di seguito sono riportate alcune linee guida generali:
Se torniamo al test colorimetrico per la rilevazione del fosfato inorganico possiamo evidenziare alcuni potenziali problemi che vengono prontamente rilevati con adeguati controlli.
Il reagente di rilevamento del fosfato fornisce una lettura bassa di circa 0,08 in una piastra a 96 pozzetti alla lunghezza d’onda utilizzata per la misurazione (circa 650 nm).
Potremmo impostare i seguenti test/controlli (letture tra parentesi in una situazione di dosaggio ipotetica):
- Tutti i componenti del test meno enzima (0.5)
- Enzima su di esso (0.1)
- Enzima più tutti gli altri componenti (1.8)
Chiaramente il segnale del test di 1.8 non è dovuto esclusivamente all’azione dell’enzima sul substrato.
Per qualsiasi saggio enzimatico, un controllo chiave (A) è quello di lasciare fuori l’enzima (e sostituire con buffer). Questo vi darà il segnale di fondo per tutti gli altri componenti di analisi come un gruppo, compreso il substrato che può contenere una piccola quantità di prodotto. Questo controllo non indica il segnale di fondo per l’enzima, ma chiaramente non è possibile aggiungere l’enzima al substrato come controllo! Nella maggior parte dei saggi l’enzima non dà alcun segnale perché viene diluito in modo significativo prima dell’uso nel saggio. Questo può essere facilmente controllato, come in B sopra.
I dati del campione A (sopra) suggeriscono che la miscela è contaminata da fosfato inorganico. I singoli componenti possono quindi essere controllati per identificare l’origine del problema. Questa situazione è abbastanza comune per i saggi di ATPasi e altri enzimi che generano fosfati, poiché i substrati sono spesso instabili e parzialmente idrolizzati per dare un po ‘ di fosfato inorganico.
Può essere difficile correggere i dati grezzi se diversi componenti danno segnali falsi; l’eliminazione del problema alla fonte è generalmente molto migliore di qualsiasi trattamento matematico. Il valore “corretto” per il campione C di cui sopra può sembrare 1.2 (cioè 1.8 – 0.5 – 0.1) ma a rigor di termini questo è sbagliato. Ricordare che la piastra di analisi più il reagente di rilevamento fornisce un segnale di fondo di circa 0,08, quindi la fonte della maggior parte del segnale per il controllo A è la plastica della piastra e/o il reagente di rilevamento. Lo stesso piccolo segnale deve anche essere nascosto all’interno del valore per il controllo enzimatico. Così nella correzione applicata sopra abbiamo sottratto questo vuoto nascosto due volte.
È sempre necessario sottrarre i controlli dai dati del test ed è preferibile combinare tutte le sostanze (eccetto l’enzima) e sottrarre un singolo valore. Se si adotta questo approccio, la curva standard viene trattata allo stesso modo e viene sottratto un valore di controllo (cioè il valore ottenuto in assenza di prodotto, cioè analogo al bianco della lastra/reagente discusso sopra). Pertanto, né i dati di analisi sottratti né la curva standard sottratta contengono il segnale di fondo potenzialmente fuorviante causato dal reagente piastra/saggio.
Infine, come abbiamo visto, i falsi segnali sono facilmente rilevabili con controlli adeguati, ma la strategia migliore per ottenere dati di buona qualità è quella di utilizzare reagenti con sfondi bassi in modo che i valori dei controlli siano bassi. È anche utile generare un segnale di analisi (dovuto all’enzima) che è molto più alto di qualsiasi segnale di fondo. Idealmente il rapporto segnale-sfondo dovrebbe essere almeno 5 e preferibilmente 10 o più per un lavoro quantitativo accurato.
Calcolo dei valori di attività
Questo è abbastanza facile da capire se calcoliamo indietro dai dati grezzi del test in modo graduale. Ad esempio, diciamo che abbiamo generato 10nmol di prodotto nella nostra reazione enzimatica (cioè determinato dalla curva standard del segnale rispetto alla quantità assoluta di prodotto). Poiché l’attività è espressa come nmol per min per ml, dobbiamo considerare il tempo e il volume e, forse meno ovviamente, la quantità e la diluizione dell’enzima per calcolare l’attività.
Se il test è lungo 10 min, il numero di nmol per min nell’esempio sopra è 1. (step1)
Se il volume del test è 200ul, dobbiamo moltiplicare per 5 (cioè 1000/200) per ottenere nmol al min per ml. (fase 2)
Questo valore si riferisce all’attività dell’enzima nel saggio, non nel campione di enzima utilizzato per impostare il saggio. Alcuni ulteriori fattori di correzione sono necessari per determinare l’attività enzimatica nel campione originale di enzima.
L’enzima può essere stato diluito prima dell’uso e deve essere ulteriormente diluito dagli altri componenti presenti nel saggio. Se il test (200ul in totale) comprende 20ul di enzima, e l’enzima è pre-diluito 1/100 prima che il campione 20ul viene aggiunto, si può probabilmente vedere che dovremmo moltiplicare prima per 10 (fase 3) e poi per 100 (fase 4) per ottenere l’attività dell’enzima nella soluzione enzimatica originale.
Finora questo è relativamente semplice. Tuttavia, abbiamo accennato in precedenza che la concentrazione è spesso tracciata sull’asse x della curva standard. Quindi i valori potrebbero essere espressi in termini MM (non mmol) e non è possibile determinare il numero di mmol semplicemente ispezionando la curva standard.
Poiché mM significa mmoli per litro, abbiamo una discrepanza tra il volume implicito di 1L e il volume effettivo del dosaggio. Quindi se abbiamo un prodotto da 10 mm e il volume del test è 200ul, dobbiamo dividere per 5000 per ottenere il numero di mmoli di prodotto.
Si può notare che dividendo per 5000 qui compensa alcune delle operazioni di moltiplicazione che sono stati richiesti sopra. In effetti, è abbastanza normale che i fattori di correzione si annullino. Ad esempio, in un test di 10 minuti utilizzando un enzima diluito 1/10, si dividerà per 10 per ottenere nmol al minuto e si moltiplicherà per 10 in seguito per correggere il fattore di diluizione.
Ne consegue che se si utilizzano sempre condizioni di dosaggio standard (es. il tuo standard), sarai in grado di moltiplicare il valore ‘x’ dalla curva standard per un singolo fattore di correzione globale, che comprende tutti gli altri fattori di correzione individuali, per calcolare i tuoi valori di attività. Solo nella prima occasione è necessario identificare i singoli fattori di correzione.
Inibizione enzimatica / Screening del farmaco
Questa è un’area di enzimologia in cui rimane la necessità di operare nell’intervallo lineare ma in cui i calcoli dei valori di attività non sono solitamente rilevanti; piuttosto, la velocità relativa di reazione (o la quantità relativa di prodotto formato) in presenza e assenza di una sostanza di prova è fondamentale, il che richiede poco più di semplici calcoli utilizzando i dati del saggio sottratti in bianco. Dopo la sottrazione dei pezzi grezzi, la quantità di prodotto risultante è espressa in percentuale della quantità ottenuta in assenza della sostanza in esame (100%). Questi test possono talvolta essere eseguiti con rapporti segnale-sfondo piuttosto bassi, perché la domanda che viene posta-la sostanza in esame inibisce la reazione?
– richiede solo una risposta sì / no.
Sommario
Si spera che questa guida abbia fornito spiegazioni chiare di “unità enzimatiche”, “attività enzimatica” e “attività enzimatica specifica”, e definizioni di unità e l’importanza della “gamma lineare”. Le specifiche di cosa tracciare sull’asse X delle curve standard sono una questione di preferenza dell’utente, ma è necessaria una certa attenzione quando vengono calcolate le attività. I controlli del dosaggio sono importanti, ma l’uso di reagenti di alta qualità è meglio che rimuovere gli sfondi utilizzando approcci matematici. Un alto rapporto segnale / sfondo è auspicabile per il lavoro quantitativo e un certo numero di parametri può essere variato per aumentare il segnale di analisi; non è sempre necessario semplicemente aggiungere più enzima. I valori di attività enzimatica possono essere calcolati facilmente se si utilizza un approccio graduale per identificare le variabili chiave del dosaggio.
Vedi altri protocolli e guide