Nome generico: eparina sodica
Forma di dosaggio: iniezione
- Hep-Lock Descrizione
- Hep-Lock – Farmacologia clinica
- Indicazioni e utilizzo per Hep-Lock
- Controindicazioni
- Avvertenze
- Ipersensibilità
- Emorragia
- Trombocitopenia
- Trombocitopenia indotta da eparina (HIT) e trombocitopenia e trombosi indotta da eparina (HITT)
- Insorgenza ritardata di HIT e HITT
- Uso nei neonati e nei lattanti
- Precauzioni
- Generale
- I test di laboratorio
- Interazioni farmacologiche
- Carcinogenesi, mutagenesi, Compromissione della fertilità
- Gravidanza
- Gravidanza Categoria C
- Madri che allattano
- Uso pediatrico
- Uso geriatrico
- Reazioni avverse
- Emorragia
- Trombocitopenia, trombocitopenia indotta da eparina (HIT) e trombocitopenia e trombosi indotta da eparina (HITT) e insorgenza ritardata di HIT e HITT
- Irritazione locale
- Ipersensibilità
- Sovradosaggio
- Sintomi
- Trattamento-Neutralizzazione dell’effetto eparina
- Hep-Lock Dosaggio e somministrazione
- Mantenimento della pervietà dei dispositivi endovenosi
- Prelievo di campioni di sangue
- Come Hep-Lucchetto in Dotazione
- Storage
Hep-Lock Descrizione
L’eparina è un gruppo eterogeneo di mucopolisaccaridi anionici a catena retta, chiamati glicosaminoglicani, con proprietà anticoagulanti. Sebbene altri possano essere presenti, i principali zuccheri che si verificano nell’eparina sono: (1) acido α-L-iduronico 2-solfato, (2) 2-deossi-2-sulfamino-α-D-glucosio 6-solfato, (3) acido β-D-glucuronico, (4) 2-acetammido-2-deossi-α-D-glucosio e (5) acido α-L-iduronico. Questi zuccheri sono presenti in quantità decrescenti, di solito nell’ordine (2)>>>>(5), e sono unite da legami glicosidici, formando polimeri di varie dimensioni. L’eparina è fortemente acida a causa del suo contenuto di solfato covalente e gruppi acidi carbossilici. Nell’eparina sodica, i protoni acidi delle unità solfato sono parzialmente sostituiti da ioni sodio.
Formula di struttura dell’eparina sodica (sotto-unità rappresentative):
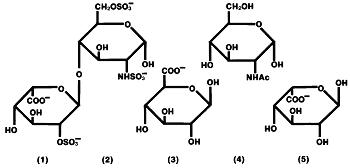
Hep-Lock U / P (Conservative-Free Heparin Lock Flush Solution, USP) è una soluzione sterile solo per il lavaggio endovenoso. Non deve essere usato per la terapia anticoagulante. Hep-Lock U / P è appositamente formulato per l’uso in situazioni in cui l’uso di conservanti non è consigliabile. Ogni ml contiene eparina sodica 10 o 100 unità USP, derivata da intestino porcino e standardizzata per l’uso come anticoagulante, sodio cloruro 8 mg, sodio fosfato monobasico monoidrato 2,3 mg e sodio fosfato bibasico anidro 0,5 mg in acqua per preparazioni iniettabili. pH 5,0-7.5. La potenza è determinata mediante analisi biologica utilizzando uno standard di riferimento USP basato su unità di attività eparina per milligrammo.
Hep-Lock – Farmacologia clinica
L’eparina inibisce le reazioni che portano alla coagulazione del sangue e alla formazione di coaguli di fibrina sia in vitro che in vivo. L’eparina agisce in più siti nel normale sistema di coagulazione. Piccole quantità di eparina in combinazione con antitrombina III (cofattore di eparina) possono inibire la trombosi inattivando il fattore X attivato e inibendo la conversione della protrombina in trombina. Una volta sviluppata la trombosi attiva, quantità maggiori di eparina possono inibire l’ulteriore coagulazione inattivando la trombina e impedendo la conversione del fibrinogeno in fibrina. L’eparina impedisce anche la formazione di un coagulo di fibrina stabile inibendo l’attivazione del fattore stabilizzante della fibrina.
Il tempo di sanguinamento di solito non è influenzato dall’eparina. Il tempo di coagulazione è prolungato da dosi terapeutiche complete di eparina; nella maggior parte dei casi, non è influenzato misurabilmente da basse dosi di eparina. I grafici loglineari delle concentrazioni plasmatiche di eparina nel tempo, per un’ampia gamma di livelli di dose, sono lineari, il che suggerisce l’assenza di processi di ordine zero. Il fegato e il sistema reticolo-endoteliale sono i siti di biotrasformazione. La curva di eliminazione bifasica, una fase alfa in rapido declino (t½ = 10 min), e dopo i 40 anni una fase beta più lenta, indica l’assorbimento negli organi. L’assenza di una relazione tra l’emivita anticoagulante e l’emivita di concentrazione può riflettere fattori come il legame proteico dell’eparina.
I pazienti di età superiore a 60 anni, a seguito di dosi simili di eparina, possono avere livelli plasmatici di eparina più elevati e tempi di tromboplastina parziale attivata (APTTS) più lunghi rispetto ai pazienti di età inferiore a 60 anni.
L’eparina non ha attività fibrinolitica; pertanto, non liserà i coaguli esistenti.
Indicazioni e utilizzo per Hep-Lock
Hep-Lock U / P (soluzione di lavaggio con heparina senza conservanti, USP) è destinato a mantenere la pervietà di un dispositivo di venipuntura a permanenza progettato per la terapia di iniezione o infusione intermittente o il prelievo di sangue. Eparina Lock Flush Soluzione può essere utilizzata dopo il posizionamento iniziale del dispositivo nella vena, dopo ogni iniezione di un farmaco o dopo il prelievo di sangue per esami di laboratorio. (Vedere DOSAGGIO E SOMMINISTRAZIONE, mantenimento della pervietà dei dispositivi per via endovenosa per le istruzioni per l’uso.)
Hep-Lock U/P non deve essere utilizzato per la terapia anticoagulante.
Controindicazioni
L’eparina sodica NON deve essere utilizzata in pazienti con le seguenti condizioni: trombocitopenia grave; uno stato di sanguinamento attivo incontrollabile (vedere AVVERTENZE), tranne quando ciò è dovuto alla coagulazione intravascolare disseminata.
Avvertenze
L’eparina non è destinata all’uso intramuscolare.
Ipersensibilità
I pazienti con ipersensibilità documentata all’eparina devono ricevere il farmaco solo in situazioni chiaramente pericolose per la vita. (Vedere REAZIONI AVVERSE, Ipersensibilità.)
Emorragia
L’emorragia può verificarsi praticamente in qualsiasi sito nei pazienti trattati con eparina. Una caduta inspiegabile dell’ematocrito, caduta della pressione sanguigna o qualsiasi altro sintomo inspiegabile dovrebbe portare a una seria considerazione di un evento emorragico.
L’eparina sodica deve essere usata con estrema cautela negli stati patologici in cui vi è un aumentato pericolo di emorragia. Alcune delle condizioni in cui esiste un aumentato pericolo di emorragia sono:
Cardiovascolare
Endocardite batterica subacuta, ipertensione grave.
Chirurgico
Durante e immediatamente dopo (a) anestesia spinale o spinale o (b) chirurgia maggiore, in particolare che coinvolge il cervello, il midollo spinale o l’occhio.
Condizioni ematologiche
associate ad un aumento delle tendenze al sanguinamento, come emofilia, trombocitopenia e alcune porpora vascolari.
Gastrointestinale
Lesioni ulcerative e drenaggio continuo del tubo dello stomaco o dell’intestino tenue.
Altro
Mestruazioni, malattie del fegato con emostasi compromessa.
Trombocitopenia
Nei pazienti trattati con eparina è stata riportata trombocitopenia con un’incidenza fino al 30%. La conta piastrinica deve essere ottenuta al basale e periodicamente durante la somministrazione di eparina. La trombocitopenia lieve (conta superiore a 100.000/mm3) può rimanere stabile o inversa anche se l’eparina viene continuata. Tuttavia, la trombocitopenia di qualsiasi grado deve essere monitorata attentamente. Se la conta scende al di sotto di 100.000/mm3 o se si sviluppa trombosi ricorrente (vedere Trombocitopenia indotta da eparina e trombocitopenia e trombosi indotta da eparina), il prodotto eparinico deve essere interrotto e, se necessario, deve essere somministrato un anticoagulante alternativo.
Trombocitopenia indotta da eparina (HIT) e trombocitopenia e trombosi indotta da eparina (HITT)
La trombocitopenia indotta da eparina (HIT) è una grave reazione mediata da anticorpi derivante dall’aggregazione irreversibile delle piastrine. HIT può progredire allo sviluppo di trombosi venose e arteriose, una condizione indicata come trombocitopenia e trombosi indotta da eparina (HITT). Eventi trombotici possono anche essere la presentazione iniziale di HITT. Questi eventi tromboembolici gravi includono trombosi venosa profonda, embolia polmonare, trombosi venosa cerebrale, ischemia degli arti, ictus, infarto miocardico, trombosi mesenterica, trombosi arteriosa renale, necrosi cutanea, cancrena delle estremità che possono portare all’amputazione e possibilmente alla morte. La trombocitopenia di qualsiasi grado deve essere monitorata attentamente. Se la conta piastrinica scende al di sotto di 100.000/mm3 o se si sviluppa trombosi ricorrente, il prodotto eparina deve essere immediatamente interrotto e si devono prendere in considerazione anticoagulanti alternativi se i pazienti richiedono una continua terapia anticoagulante.
Insorgenza ritardata di HIT e HITT
Trombocitopenia indotta da eparina e trombocitopenia e trombosi indotte da eparina possono verificarsi fino a diverse settimane dopo l’interruzione della terapia con eparina. I pazienti che presentano trombocitopenia o trombosi dopo la sospensione di eparina devono essere valutati per HIT e HITT.
Uso nei neonati e nei lattanti
La concentrazione di 100 unità / mL non deve essere utilizzata nei neonati o nei lattanti di peso inferiore a 10 kg a causa del rischio di anticoagulazione sistemica. È necessaria cautela quando si utilizza la concentrazione di 10 unità/mL nei neonati prematuri di peso inferiore a 1 kg che ricevono frequenti vampate poiché una dose terapeutica di eparina può essere somministrata al neonato in un periodo di 24 ore.
Precauzioni
Generale
Le precauzioni devono essere esercitate quando i farmaci incompatibili con l’eparina vengono somministrati attraverso un catetere endovenoso permanente contenente una soluzione di blocco di eparina priva di conservanti. (SeeDOSAGE E SOMMINISTRAZIONE, mantenimento della pervietà dei dispositivi endovenosi.) La concentrazione di fosforo nella soluzione di eparina è 0,63 mg / ml.
Trombocitopenia, trombocitopenia indotta da eparina (HIT) e trombocitopenia e trombosi indotta da eparina (HITT)
Avvertimenti
Aumento del rischio per i pazienti più anziani, in particolare le donne
È stata riportata una maggiore incidenza di sanguinamento in pazienti, in particolare donne, di età superiore ai 60 anni.
I test di laboratorio
La conta piastrinica periodica, l’ematocrito e i test per il sangue occulto nelle feci sono raccomandati durante l’intero corso della terapia con eparina, indipendentemente dalla via di somministrazione. (SeeDOSAGE E SOMMINISTRAZIONE.)
Interazioni farmacologiche
Inibitori piastrinici
Farmaci come acido acetilsalicilico, destrano, fenilbutazone, iprofene, indometacina, dipiridamolo, idrossiclorochina e altri che interferiscono con le reazioni di aggregazione piastrinica (la principale difesa emostatica dei pazienti eparinizzati) possono indurre sanguinamento e devono essere usati con cautela nei pazienti trattati con eparina sodica.
Altre interazioni
La digitale, le tetracicline, la nicotina o gli antistaminici possono parzialmente contrastare l’azione anticoagulante dell’eparina sodica.
Carcinogenesi, mutagenesi, Compromissione della fertilità
Non sono stati condotti studi a lungo termine sugli animali per valutare il potenziale cancerogeno dell ‘ eparina sodica. Inoltre, non sono stati effettuati studi sulla riproduzione negli animali riguardo alla mutagenesi o alla compromissione della fertilità.
Gravidanza
Effetti teratogeni
Gravidanza Categoria C
Non sono stati condotti studi sulla riproduzione animale con eparina sodica. Inoltre, non è noto se l’eparina sodica possa causare danni fetali quando somministrata a una donna incinta o possa influire sulla capacità riproduttiva. L’eparina sodica deve essere somministrata a una donna incinta solo se chiaramente necessario.
Effetti non teratogeni
L’eparina non attraversa la barriera placentare.
Madri che allattano
L’eparina non viene escreta nel latte materno.
Uso pediatrico
La sicurezza e l’efficacia nei pazienti pediatrici non sono state stabilite (vedere AVVERTENZE, Uso nei neonati e nei neonati).
Uso geriatrico
È stata riportata una maggiore incidenza di sanguinamento in pazienti di età superiore ai 60 anni, in particolare donne (vedere FARMACOLOGIA CLINICA e PRECAUZIONI generali).
Reazioni avverse
Emorragia
L’emorragia è la principale complicazione che può derivare dall’uso di eparina (seeWARNINGS, Emorragia). Un tempo di coagulazione eccessivamente prolungato o un sanguinamento minore durante la terapia può essere solitamente controllato ritirando il farmaco (vedere SOVRADOSAGGIO).
Trombocitopenia, trombocitopenia indotta da eparina (HIT) e trombocitopenia e trombosi indotta da eparina (HITT) e insorgenza ritardata di HIT e HITT
Avvertimenti.
Irritazione locale
Con l ‘ uso della soluzione di Heparin Lock Flush sono stati riportati irritazione locale ed eritema.
Ipersensibilità
Sono state riportate reazioni di ipersensibilità generalizzata, con brividi, febbre e orticaria come le manifestazioni più comuni, e asma, rinite, lacrimazione, cefalea, nausea e vomito e reazioni anafilattoidi, incluso shock, che si sono verificate più raramente. Possono verificarsi prurito e bruciore, specialmente sul lato plantare dei piedi.
Nei pazienti trattati con eparina è stata riportata trombocitopenia con un’incidenza fino al 30%. Mentre spesso lieve e senza alcun significato clinico evidente, tale trombocitopenia può essere accompagnata da gravi complicanze tromboemboliche come necrosi cutanea, cancrena delle estremità che possono portare ad amputazione, infarto miocardico, embolia polmonare, ictus e possibilmente morte. (Vedere AVVERTENZE e PRECAUZIONI.)
Alcuni episodi di arti dolorosi, ischemici e cianosi sono stati in passato attribuiti a reazioni allergiche vasospastiche. Resta da determinare se questi siano in realtà identici alle complicanze associate alla trombocitopenia.
Sovradosaggio
Sintomi
Il sanguinamento è il principale segno di sovradosaggio di eparina. Sangue dal naso, sangue nelle urine o feci catramose possono essere notati come il primo segno di sanguinamento. Lividi facili o formazioni petecchiali possono precedere il sanguinamento franco.
Trattamento-Neutralizzazione dell’effetto eparina
Quando le circostanze cliniche (sanguinamento) richiedono l’inversione dell’eparinizzazione, il solfato di protamina (soluzione all ‘ 1%) mediante infusione lenta neutralizzerà l’eparina sodica. Non devono essere somministrati più di 50 mg, molto lentamente, in un periodo di 10 minuti. Ogni mg di solfato di protamina neutralizza circa 100 unità di eparina USP. La quantità di protamina richiesta diminuisce nel tempo man mano che l’eparina viene metabolizzata. Sebbene il metabolismo dell’eparina sia complesso, ai fini della scelta di una dose di protamina si può presumere che abbia un’emivita di circa 1/2 ora dopo l’iniezione endovenosa.
La somministrazione di protamina solfato può causare gravi reazioni ipotensive e anafilattoidi. Poiché sono state riportate reazioni fatali che spesso assomigliano all’anafilassi, il farmaco deve essere somministrato solo quando le tecniche di rianimazione e il trattamento dello shock anafilattoide sono prontamente disponibili.
Per ulteriori informazioni consultare l’etichettatura di Protamine Sulfate Injection, USP products.
Hep-Lock Dosaggio e somministrazione
I farmaci parenterali devono essere ispezionati visivamente per la presenza di particolato e scolorimento prima della somministrazione, ogni volta che la soluzione e il contenitore lo consentono. Una leggera decolorazione non altera la potenza.
L ‘ uso di eparina Lock Flush Soluzione priva di conservanti nella concentrazione di 100 unità / mL non è raccomandato nei neonati e nei lattanti (vedere AVVERTENZE, Uso nei neonati e nei lattanti).
Mantenimento della pervietà dei dispositivi endovenosi
Per prevenire la formazione di coaguli in un set di blocco eparina o catetere venoso centrale dopo il suo corretto inserimento, la soluzione di lavaggio con blocco eparina, USP viene iniettata tramite il mozzo di iniezione in una quantità sufficiente a riempire l’intero dispositivo. Questa soluzione deve essere sostituita ogni volta che viene utilizzato il dispositivo. Aspirare prima di somministrare qualsiasi soluzione tramite il dispositivo per confermare la pervietà e la posizione della punta dell’ago o del catetere. Se il farmaco da somministrare è incompatibile con l’eparina, l’intero dispositivo deve essere lavato con soluzione salina normale prima e dopo la somministrazione del farmaco; dopo il secondo lavaggio salino, la soluzione di lavaggio con blocco di eparina, USP può essere reinsillata nel dispositivo. Le istruzioni del produttore del dispositivo devono essere consultate per le specifiche relative al suo utilizzo. Di solito questa soluzione diluita di eparina manterrà l’anticoagulazione all’interno del dispositivo fino a 4 ore.
NOTA: Poiché iniezioni ripetute di piccole dosi di eparina possono alterare i test per il tempo di tromboplastina parziale attivata (APTT), un valore basale per APTT deve essere ottenuto prima dell’inserimento di un dispositivo endovenoso.
Prelievo di campioni di sangue
Soluzione senza conservanti di eparina Lock Flush, USP può essere utilizzato anche dopo ogni prelievo di sangue per esami di laboratorio. Quando l’eparina interferisce o altera i risultati degli esami del sangue, la soluzione di eparina deve essere eliminata dal dispositivo aspirandola e scartandola prima di prelevare il campione di sangue.
Come Hep-Lucchetto in Dotazione
Hep-Lock U/P (Conservanti, Eparina Blocco a Filo Soluzione, USP)
10 unità USP/mL
1 mL DOSETTE fiale confezionato in 25s (NDC 0641-0272-25)
100 unità USP/mL
1 mL DOSETTE fiale confezionato in 25s (NDC 0641-0273-25)
Storage
Conservare a 20°-25°C (68°-77°F) .
- Tahata T, Shigehito M, Kusuhara K, Ueda Y, et al. Ritardata insorgenza di trombocitopenia indotta da eparina-A Case Report – J Jpn Assn Torca Surg. 1992; 40 (3): 110-111.
- Warkentin T, Kelton J. Trombocitopenia e trombosi indotte da eparina a insorgenza ritardata. Annali di Medicina Interna. 2001;135:502-506.
- Rice L, Attisha W, Drexler A, Francis J. Trombocitopenia indotta da eparina a insorgenza ritardata. Annali di Medicina Interna, 2002;136: 210-215.
- Dieck J., C. Rizo-Patron, et al. (1990). “Una nuova manifestazione e trattamento alternativo per la trombosi indotta da eparina.” Petto.1990;98:1524-26.
- Smythe M, Stephens J, Mattson. Trombocitopenia indotta da eparina a insorgenza ritardata. Annali di Medicina d’urgenza, 2005;45(4):417-419.
- Divgi A. (Ristampa), Thumma S., Hari P., Friedman K., trombocitopenia indotta da eparina a insorgenza ritardata (HIT) che si presenta dopo esposizione al farmaco non documentata come embolia polmonare post-angiografia. Sangue. 2003; 102(11):127b.
ESI logo, Hep-Lock e Dosette sono marchi registrati di Baxter International, Inc., o le sue controllate.
Prodotto da
Baxter Healthcare Corporation
Deerfield, IL 60015 USA
Per la richiesta del prodotto 1 800 ANA DRUG (1-800-262-3784)
MLT-00090/6.0
| Hep-Lock U/P heparin sodium injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
| Hep-Lock U/P heparin sodium injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Baxter Healthcare Corporation
Medical Disclaimer