Meccanismi di catalisi enzimatica
Il legame di un substrato al sito attivo di un enzima è un’interazione molto specifica. I siti attivi sono fessure o solchi sulla superficie di un enzima, solitamente composti da amminoacidi provenienti da diverse parti della catena polipeptidica che sono riuniti nella struttura terziaria della proteina piegata. I substrati inizialmente legano al sito attivo dalle interazioni noncovalent, compreso i legami idrogeno, i legami ionici e le interazioni idrofobiche. Una volta che un substrato è legato al sito attivo di un enzima, più meccanismi possono accelerare la sua conversione al prodotto della reazione.
Sebbene il semplice esempio discusso nella sezione precedente riguardasse solo una singola molecola di substrato, la maggior parte delle reazioni biochimiche coinvolgono interazioni tra due o più substrati diversi. Ad esempio, la formazione di un legame peptidico comporta l’unione di due amminoacidi. Per tali reazioni, il legame di due o più substrati al sito attivo nella posizione e nell’orientamento corretti accelera la reazione (Figura 2.23). L’enzima fornisce un modello su cui i reagenti sono riuniti e adeguatamente orientati per favorire la formazione dello stato di transizione in cui interagiscono.

Figura 2.23
Catalisi enzimatica di una reazione tra due substrati. L’enzima fornisce un modello su cui i due substrati sono riuniti nella posizione e nell’orientamento corretti per reagire l’uno con l’altro.
Gli enzimi accelerano le reazioni anche alterando la conformazione dei loro substrati per avvicinarsi a quella dello stato di transizione. Il modello più semplice di interazione enzima-substrato è il modello lock-and-key, in cui il substrato si inserisce precisamente nel sito attivo (Figura 2.24). In molti casi, tuttavia, le configurazioni sia dell’enzima che del substrato sono modificate dal legame del substrato-un processo chiamato adattamento indotto. In questi casi la conformazione del substrato viene alterata in modo che assomigli più da vicino a quella dello stato di transizione. Lo stress prodotto da tale distorsione del substrato può facilitare ulteriormente la sua conversione allo stato di transizione indebolendo i legami critici. Inoltre, lo stato di transizione è stabilizzato dal suo stretto legame con l’enzima, riducendo così l’energia richiesta di attivazione.

Figura 2.24
Modelli di interazione enzima-substrato. (A) Nel modello lock-and-key, il substrato si inserisce precisamente nel sito attivo dell’enzima. B) Nel modello induced-fit, il legame al substrato distorce le conformazioni sia del substrato che dell’enzima. Questa distorsione (più…)
Oltre a riunire più substrati e distorcere la conformazione dei substrati per avvicinarsi allo stato di transizione, molti enzimi partecipano direttamente al processo catalitico. In tali casi, specifiche catene laterali di aminoacidi nel sito attivo possono reagire con il substrato e formare legami con intermedi di reazione. Gli amminoacidi acidi e basici sono spesso coinvolti in questi meccanismi catalitici, come illustrato nella seguente discussione sulla chimotripsina come esempio di catalisi enzimatica.
La chimotripsina è un membro di una famiglia di enzimi (proteasi della serina) che digeriscono le proteine catalizzando l’idrolisi dei legami peptidici. La reazione può essere scritta come segue:

I diversi membri della famiglia della serina proteasi (tra cui chimotripsina, tripsina, elastasi e trombina) hanno specificità di substrato distinte; essi preferenzialmente fendono legami peptidici adiacenti a diversi aminoacidi. Ad esempio, mentre la chimotripsina digerisce i legami adiacenti agli amminoacidi idrofobici, come il triptofano e la fenilalanina, la tripsina digerisce i legami accanto agli amminoacidi basici, come la lisina e l’arginina. Tutte le proteasi della serina, tuttavia, sono simili nella struttura e utilizzano lo stesso meccanismo di catalisi. I siti attivi di questi enzimi contengono tre aminoacidi critici-serina, istidina e aspartato-che guidano l’idrolisi del legame peptidico. Infatti, questi enzimi sono chiamati proteasi della serina a causa del ruolo centrale del residuo della serina.
I substrati si legano alle serine proteasi inserendo l’amminoacido adiacente al sito di scissione in una tasca nel sito attivo dell’enzima (Figura 2.25). La natura di questa tasca determina la specificità del substrato dei diversi membri della famiglia della serina proteasi. Ad esempio, la tasca legante della chimotripsina contiene aminoacidi idrofobici che interagiscono con le catene laterali idrofobe dei suoi substrati preferiti. Al contrario, la tasca legante della tripsina contiene un amminoacido acido caricato negativamente (aspartato), che è in grado di formare un legame ionico con i residui di lisina o arginina dei suoi substrati.
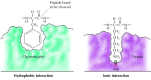
Figura 2.25
Legame al substrato mediante serine proteasi. L’amminoacido adiacente al legame peptidico da scindere viene inserito in una tasca nel sito attivo dell’enzima. In chimotripsina, la tasca lega gli amminoacidi idrofobici; la tasca legante di tripsina contiene (più…)
Il legame del substrato posiziona il legame peptidico da scindere adiacente alla serina del sito attivo (Figura 2.26). Il protone di questa serina viene quindi trasferito all’istidina del sito attivo. La conformazione del sito attivo favorisce questo trasferimento di protoni perché l’istidina interagisce con il residuo di aspartato caricato negativamente. La serina reagisce con il substrato, formando uno stato di transizione tetraedrico. Il legame peptidico viene quindi scisso e la porzione C-terminale del substrato viene rilasciata dall’enzima. Tuttavia, il peptide N-terminale rimane legato alla serina. Questa situazione si risolve quando una molecola d’acqua (il secondo substrato) entra nel sito attivo e inverte le reazioni precedenti. Il protone della molecola d’acqua viene trasferito all’istidina e il suo gruppo idrossilico viene trasferito al peptide, formando un secondo stato di transizione tetraedrico. Il protone viene quindi trasferito dall’istidina alla serina e il peptide viene rilasciato dall’enzima, completando la reazione.

Figura 2.26
Meccanismo catalitico della chimotripsina. Tre aminoacidi nel sito attivo (Ser-195, His-57 e Asp-102) svolgono ruoli critici nella catalisi.
Questo esempio illustra diverse caratteristiche della catalisi enzimatica; la specificità delle interazioni enzima-substrato, il posizionamento di diverse molecole di substrato nel sito attivo e il coinvolgimento dei residui del sito attivo nella formazione e stabilizzazione dello stato di transizione. Sebbene le migliaia di enzimi nelle cellule catalizzino molti diversi tipi di reazioni chimiche, gli stessi principi di base si applicano al loro funzionamento.