Qual è il potenziale redox di una cella?
Modalità lettore
I potenziali Redox sono utilizzati per caratterizzare il costo energetico libero e la direzione delle reazioni che coinvolgono il trasferimento di elettroni, una delle reazioni biochimiche più onnipresenti e importanti. Tali reazioni di riduzione-ossidazione sono caratterizzate da un cambiamento di energia libera che condivide alcune caratteristiche concettuali con quella usata per descrivere il pKa nelle reazioni acido-base in cui è coinvolto il trasferimento di protoni piuttosto che il trasferimento di elettroni. In questa vignetta, una delle più astratte del libro, discutiamo di come il potenziale redox può essere utilizzato come misura della forza trainante per una determinata reazione di riduzione dell’ossidazione di interesse. A titolo di contrasto, a differenza del pH, non ha senso in cui si possa assegnare un singolo potenziale redox a un’intera cellula.
Il potenziale redox, o più precisamente il potenziale di riduzione, di un composto si riferisce alla sua tendenza ad acquisire elettroni e quindi ad essere ridotto. Alcuni lettori potrebbero ricordare il mnemonico ” OILRIG “che ci ricorda che” l’ossidazione è perdita, la riduzione è guadagno”, dove la perdita e il guadagno sono di elettroni. Si consideri una reazione che coinvolge un trasferimento di elettroni : Aox + ne – ↔ Ared dove n elettroni sono assorbiti dalla forma ossidata (Aox) per dare la forma ridotta (Ared) del composto A. La differenza di potenziale redox ΔE tra il donatore di elettroni e l’accettore è correlata alla variazione di energia libera associata ΔG della reazione tramite ΔG=nFΔE dove n è il numero di elettroni trasferiti e F è la costante di Faraday (96,485 J/mol/V o ≈100 kJ/mol/V). Ispezionando i valori tabulati di questi potenziali, è possibile sviluppare un’intuizione per la tendenza al trasferimento di elettroni e, quindi, della direzione della reazione.

Figura 1: Una “torre redox” che mostra il potenziale redox delle mezze reazioni metaboliche comuni. I processi metabolici possono essere visti come elettroni in movimento tra le molecole, spesso catturando parte dell’energia rilasciata mentre gli elettroni si muovono da alta energia a stati energetici più bassi come nella glicolisi o nella respirazione. Gli elettroni donati dalle “mezze reazioni” in cima possono essere consumati in una mezza reazione più in basso sulla torre per completare una reazione termodinamicamente favorevole. Ad esempio, il processo netto di glicolisi comporta l’ossidazione del glucosio a piruvato accoppiato alla riduzione di NAD+ a NADH. Poiché l’ossidazione del glucosio si trova nella parte superiore della torre e la riduzione di NAD+ è al di sotto di essa, questo flusso di elettroni è termodinamicamente favorevole. Confrontando con la barra della scala di idrolisi dell’ATP possiamo anche vedere che questo flusso di elettroni è abbastanza favorevole da generare ATP. La respirazione aerobica comporta molti trasferimenti di elettroni intermedi attraverso la catena di trasporto degli elettroni. Molte di queste transizioni sono indicate, compreso il succinato di ossidazione a fumarato che meccanicamente è accoppiato alla riduzione di ubiquinone a ubiquinolo nelle membrane mitochrondrial interne. Ciascuno di questi trasferimenti di elettroni intermedi deve essere termodinamicamente favorevole da solo in modo che la respirazione proceda. Confrontando con la “scala di idrolisi dell’ATP” possiamo vedere che le singole trasformazioni nella catena di trasporto degli elettroni non sono abbastanza energetiche per generare ATP da sole. Eppure sono abbastanza favorevoli per pompare un protone attraverso la membrana cellulare o mitocondriale. Questa è la base energetica per la chemiosmosi: le cellule immagazzinano quanti di energia troppo piccoli per la sintesi di ATP nel gradiente protonico attraverso una membrana. Tale energia viene successivamente utilizzata per generare ATP convertendo il gradiente H+ in legami fosfoanidrici sull’ATP attraverso l’ATP sintasi.
Sebbene l’ATP sia spesso affermato come la valuta energetica della cellula, infatti, per l’equilibrio energetico della cellula i portatori di potere riducente non sono essi stessi meno importanti. L’esempio più importante di questi vettori è la molecola NADH nelle sue forme ridotte o ossidate (NAD+). Possiamo usare il potenziale redox per collegare questi due protagonisti molecolari e stimare un limite superiore sul numero di molecole di ATP che possono essere prodotte dall’ossidazione del NADH (prodotto, ad esempio, nel ciclo TCA). Il NAD+/NADH coppia ha un potenziale redox di E = -0.32 V e si è ossidato dall’ossigeno per dare acqua (protoni provenienti dai media) con un potenziale redox di E = +0.82 V. Entrambi sono mostrati in Figura 1 come parte di un “redox torre” di chiave biologica, mezzo di reazioni, che possono essere collegati a trovare il complessivo potenziale redox cambiamento e quindi l’energia libera. Per la reazione considerata al di sopra di NADH ossidazione con l’ossigeno, il massimo associato libero di energia che può essere estratta è così
∆ G = n x F x ∆ E = 2 x 100 kJ/(molxV) x (0.82-(-0.32)) V = 230 kJ/mol≈ 90 kBT,
dove n=2 e F≈100kJ/mol/V. idrolisi dell’ATP è una variazione di energia libera di ≈50kJ/mol in condizioni fisiologiche che possiamo trovare 228 kJ/mol sufficiente per produrre un massimo di 228/50≈4.5 ATPs. Nella cellula, l’ossidazione del NADH procede attraverso diversi passaggi nella respirazione e porta al trasferimento di 10 protoni attraverso la membrana contro il potenziale elettrochimico (BNID 101773). Questi trasferimenti di protoni corrispondono a un altro modo di catturare l’energia biochimica. Questa energia viene quindi utilizzata dall’ATPasi per produrre 2-3 ATPS. Troviamo così che circa la metà dell’energia che è stata rilasciata nel trasferimento di elettroni dal NADH all’ossigeno è conservata in ATP. Garantire che la reazione proceda in modo direzionale per produrre ATP piuttosto che consumarlo richiede che parte dell’energia sia “sprecata” poiché il sistema deve essere fuori equilibrio.
Perché si dovrebbero discutere i potenziali redox delle mezze reazioni e non le energie libere delle reazioni complete? Le unità stesse devono le loro origini alla capacità nel campo dell’elettrochimica di misurare in laboratorio la differenza di tensione, cioè il potenziale misurato in volt, attraverso due camere che contengono diversi portatori di elettroni, e di fermare la reazione netta con una tensione. L’utilità dei potenziali redox per le mezze reazioni sta nella capacità di assemblare combinazioni di diversi donatori e accettori per valutare la fattibilità termodinamica e il guadagno energetico di ogni reazione considerata. Se si dispone di k possibili composti di trasferimento di elettroni, le possibili reazioni ~ k2 possono essere previste in base solo ai potenziali redox K.
Proprio mentre parliamo del pH di una soluzione, a prima ipotesi, potremmo immaginare che sarebbe possibile parlare di un potenziale redox apparentemente analogo della cellula. Sapendo che la concentrazione del ridotto e ossidato forme di una data coppia di reazione definisce la loro piscina potenziale redox tramite la relazione
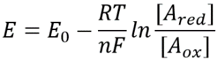
Tabella 1: coefficienti di concentrazione del comune donatore di elettroni coppie di NAD/NADH e NADP/NADPH. Come si può vedere il primo è relativamente ossidato e il secondo relativamente ridotto con un rapporto tra loro di solito molto più grande di 1.
Questa equazione (una cosiddetta equazione di Nernst) fornisce il valore del potenziale redox in condizioni di concentrazione tipiche della cella rispetto alle condizioni di stato standard (dove per definizione =). Ad esempio, si consideri la donazione di un elettrone a NAD + con conseguente forma ossidata NADH. Nella matrice mitocondriale è riportato un rapporto di 10 volte più della forma ossidata (BNID 100779) come mostrato nella Tabella 1. In questo caso, troviamo che il fattore è ≈30 mV e quindi il potenziale redox cambia da -0,32 V a -0,29 V. Per assicurarci che la direzione dell’effetto che abbiamo ottenuto sia ragionevole notiamo che con una sovrabbondanza della forma ossidata la tendenza ad essere ossidata dall’ossigeno è leggermente inferiore come si vede dal fatto che il potenziale redox è ora più vicino di prima a quello della coppia di scambio di elettroni ossigeno/acqua (+0,82 V).
Una cella non è in equilibrio e c’è un accoppiamento debole tra diverse coppie redox. Questa situazione porta alla creazione di diversi potenziali redox per coesistere coppie redox nella cellula. Se i flussi di produzione e utilizzo delle forme ridotte e ossidate di una coppia redox, Ared e Aox e un altro Bred e Box, sono molto più grandi del loro flusso interconversione, Ared+Box<>Aox+Bred allora A e B possono avere potenziali redox molto diversi. Di conseguenza è mal definito chiedere il potenziale redox complessivo della cellula in quanto sarà diverso per i diversi componenti all’interno della cellula. A titolo di contrasto, il pH della cellula (o di qualche compartimento in esso) è molto meglio definito poiché l’acqua funge da mezzo universale che accoppia le diverse reazioni acido-base ed equilibra ciò che è noto come potenziale chimico di tutte le specie.
Per una data coppia redox in un dato compartimento cellulare il rapporto di concentrazione delle due forme prescrive il potenziale redox in modo ben definito. I composti che scambiano rapidamente elettroni saranno in equilibrio relativo e quindi condividono un potenziale redox simile. Per vedere come queste idee si svolgono, è quindi molto utile considerare una coppia redox che partecipa a molte reazioni cellulari chiave e, di conseguenza, è strettamente correlata allo stato redox di molti composti. Il glutatione nel citoplasma è un composto in quanto partecipa alla riduzione e all’ossidazione dei legami tiolici altamente prevalenti (quelli contenenti zolfo) negli amminoacidi cisteina di molte proteine. Il glutatione è un tripeptide (composto da 3 amminoacidi), quello centrale una cisteina che può essere in forma ridotta (GSH) o ossidata dove forma un dimero con una cisteina da un’altra molecola di glutatione (indicata GSSG). La mezza reazione per il glutatione è quindi 2 x GSH <> GSSG + 2e– + 2H+. L’altra metà reazione è spesso un legame di zolfo che viene “aperto” in una proteina ricettiva, mantenendosi così nella forma ridotta a causa dell’azione costante del glutatione. Il glutatione è anche un giocatore dominante nel neutralizzare i composti reattivi che hanno un’alta tendenza a strappare gli elettroni e quindi ossidare altre molecole. Tali composti sono fatti sotto stress ossidativo come ad esempio quando viene raggiunta la capacità delle reazioni di trasferimento di elettroni della respirazione o della fotosintesi. Collettivamente chiamati ROS (reactive oxygen species) possono creare scompiglio nella cellula e sono implicati in molti processi di invecchiamento. Il duplice ruolo del glutatione nel mantenere le proteine piegate correttamente e limitare il ROS, così come la sua reattività di trasferimento di elettroni e concentrazione relativamente elevata, lo rendono il proxy principale per lo stato redox della cellula. La concentrazione di glutatione nella cellula è ≈10mM (BNID 104679, 104704, 111464), rendendolo il secondo metabolita più abbondante nella cellula (dopo il glutammato) assicurando che svolga un ruolo dominante come donatore di elettroni nel controllo redox della funzione proteica. In altre funzioni delle cellule ci sono altre coppie di elettroni dominanti. Nelle reazioni anaboliche biosintetiche la coppia NADP + / NADPH e nelle reazioni cataboliche di rottura è NAD + / NADH.
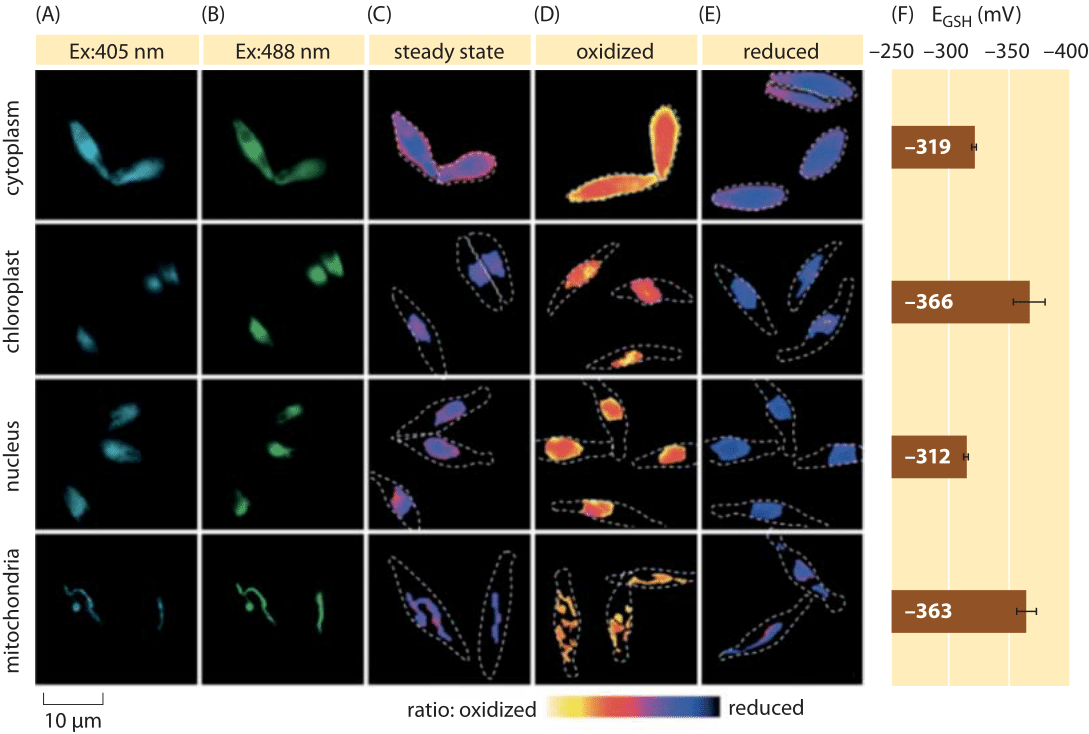
Figura 2: Imaging del potenziale redox subcellulare del pool di glutatione nelle alghe diatomee in vivo. Microscopia a fluorescenza imaging di cellule di P. tricornutum che esprimono roGFP2 in varie localizzazioni subcellulari. Le immagini di fluorescenza a due lunghezze d’onda di eccitazione (A, B) sono state divise per ottenere valori raziometrici (C). Per la calibrazione, le immagini raziometriche vengono catturate in condizioni di forte ossidante (150 mm H2O2) (D) e riducente (1 mM DTT) (E). Le linee tratteggiate rappresentano il contorno delle celle, disegnate in base alle immagini del campo luminoso. (F) Il potenziale redox allo stato stazionario del pool di glutatione, EGSH in mV, è stato calcolato sulla base dell’equazione di Nernst utilizzando il livello di ossidazione sotto i valori di pH dati per ciascun organello. Adattato da: S. Graff van Creveld et al., ISME J., 9: 385, 2015.
Come si fa a misurare i potenziali redox nelle cellule viventi? Ancora un altro beneficiario della rivoluzione delle proteine fluorescenti è stato oggetto di potenziali redox. Un reporter GFP è stato progettato per essere redox sensibile per incorporazione di aminoacidi cisteina che influenzano la fluorescenza in base alla loro riduzione da parte del pool di glutatione. La figura 2 mostra il risultato dell’utilizzo di tale reporter per esaminare il potenziale redox del glutatione in diversi compartimenti di una diatomea.
Dalle misurazioni dello stato redox del pool di glutatione in diversi organelli cellulari e in condizioni variabili possiamo dedurre il rapporto tra le concentrazioni delle forme ridotte e ossidate. I valori variano da circa -170 mV nell’ER e nelle cellule apoptotiche a circa -300 mV nella maggior parte degli altri organelli e nelle cellule di proliferazione (BNID 103543, 101823, 111456, 111465). Dato che il potenziale redox standard del glutatione è -240 mV (BNID 111453, 111463), qual è il rapporto tra glutatione ridotto e glutatione ossidato? Usando l’equazione di Nernst (o equivalentemente, dalla distribuzione di Boltzmann), una variazione di dieci volte nel rapporto prodotto/reagente corrisponde ad un aumento di ≈6 kJ/mol in energia libera (≈2 kBT). Dati i 2 elettroni trasferiti nella reazione GSH/GSSG questa variazione del rapporto di concentrazione è solitamente pari a 30mV, anche se per il glutatione, la stechiometria di 2 molecole GSH che si fondono in una molecola legata covalentemente a GSSG rende questa solo un’approssimazione. La variazione di 100 mV riportata tra le condizioni riflette un rapporto di concentrazioni tra quantità circa uguali delle forme ridotte e ossidate (nelle cellule apoptotiche) a oltre 1.000 volte più concentrazione della forma ridotta. Infatti nella maggior parte delle condizioni cellulari la forma ossidata è solo una frazione molto piccola del pool complessivo, ma ancora con implicazioni fisiologiche.
Un aspetto confuso delle reazioni redox è che il trasferimento può assumere diverse forme. In un caso sono solo elettroni come nelle reazioni effettuate dai citocromi nelle catene di trasferimento di elettroni. In un altro caso comune è una combinazione di elettroni e protoni come nel cofattore NAD+ / NADH dove vengono trasferiti due elettroni e un protone (H+). Infine, ci sono le reazioni in cui viene trasferito lo stesso numero di elettroni e protoni quando si sarebbe naturalmente tentati di discutere il trasferimento di idrogeni. Questo è ad esempio il caso della reazione generale di ossidazione del glucosio in cui l’ossigeno viene ridotto all’acqua. Due idrogeni sono stati quindi trasferiti, quindi si dovrebbe discutere il trasferimento di elettroni, idrogeni o protoni? La definizione del potenziale redox (data sopra) si concentra solo sullo “stato”dell’elettrone. Che dire dei protoni e cosa succede a questi quando si incontra una catena di reazioni di trasferimento di elettroni in cui alcuni composti intermedi contengono i protoni di idrogeno e altri no? La spiegazione risiede nell’acqua circostante e nel loro pH. La reazione avviene ad un dato pH e i composti reagenti sono in equilibrio con questo pH e quindi emettere o ricevere un protone non ha alcun effetto sull’energetica. Il mezzo acquoso funge da pool in cui i protoni possono essere “parcheggiati” quando la reazione di trasferimento è esclusivamente di elettroni (l’analogia presa in prestito dal libro introduttivo di biochimica molto accessibile “The chemistry of life” di Steven Rose). Questi protoni parcheggiati possono essere presi in prestito nelle fasi successive come avviene nella fase finale della respirazione ossidativa in cui la citocromo ossidasi prende protoni dal mezzo. Poiché si presume che l’acqua sia onnipresente, non è necessario tenere conto dei protoni tranne che per conoscere il pH prevalente che descrive la tendenza a dare o ricevere protoni. This is the reason why we discuss electron donors and acceptors rather than hydrogen donors and acceptors.




